题目内容
【题目】在某个容积为2L的密闭容器内,在T℃时按图1所示发生反应: 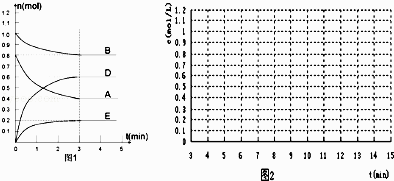
mA(g)+nB(g)pD(g)+qE(s)H<0(m、n、p、q为最简比例的整数).
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为mol/(Lmin); 方程式中m:n:p:q=
(2)该反应的化学平衡常数K为(保留至一位小数);
(3)下列措施能增大B的转化率的是 A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E.保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是 A.恒容恒温时容器中气体压强保持不变 B.混合气体中D浓度不变
C.v(A)正=v(A)逆 D.恒容时容器中气体密度不变
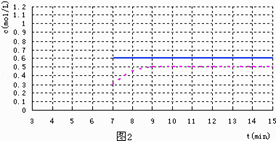
(5)反应达到平衡后,第7min时,改变条件,在第9min达到新的平衡,在图2上作出第7min至第15min 下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
【答案】
(1)0.1;2:1:3:1
(2)1.7
(3)C、E
(4)B、C、D
(5)
【解析】解:(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为 ![]() =0.1 mol/(Lmin);物质的量变化量之比等于化学计量数之比,则方程式中m:n:p:q=2:1:3:1,所以答案是:0.1 mol/(Lmin);2:1:3:1;(2)A、B减少,C、D增加,则A、B为反应物、C、D为生成物,物质的量变化量之比为2:1:3:1,则
=0.1 mol/(Lmin);物质的量变化量之比等于化学计量数之比,则方程式中m:n:p:q=2:1:3:1,所以答案是:0.1 mol/(Lmin);2:1:3:1;(2)A、B减少,C、D增加,则A、B为反应物、C、D为生成物,物质的量变化量之比为2:1:3:1,则
2A(g)+ | B(g) | 3D(g)+ | E(s) | ||
开始 | 0.4 | 0.5 | 0 | ||
转化 | 0.2 | 0.1 | 0.3 | ||
平衡 | 0.2 | 0.4 | 0.3 |
K= ![]() =1.7,
=1.7,
所以答案是:1.7;(3)A.升高温度,平衡逆向移动,转化率减小,故A不选;
B.保持体积不变通入1molB,B的转化率减小,故B不选;
C.保持体积不变移出部分物质D(g),平衡正向移动,B的转化率增大,故C选;
D.该反应为体积不变的反应,将容器的容积增大为原来的2倍,平衡不移动,故D不选;
E.保持体积不变通入1mol A,平衡正向移动,B的转化率增大,故E选;
所以答案是:C、E;(4)A.恒容恒温时容器中气体压强始终保持不变,不能判定平衡,故A不选;
B.混合气体中D浓度不变,为平衡特征“定”,可判定,故B选;
C.v(A)正=v(A)逆 , 为平衡特征“等”可判定,故C选;
D.气体的质量为变量,则恒容时容器中气体密度不变,达到平衡状态,故D选;
所以答案是:B、C、D;(5)①若降低温度且平衡时D物质的量变化了0.4mol,平衡正向移动,生成D,且反应速率加快(用虚线);
②若将容器的容积压缩为原来一半,平衡不移动(用实线),起点在第7分钟,拐点在第9分钟,且降低温度的图像不能超越0.6mol/L,图像为 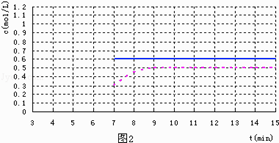 ,所以答案是:
,所以答案是:  .
.
【考点精析】利用化学平衡状态本质及特征和化学平衡状态的判断对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 天然气 | 硫酸 | 干冰 |
B | 氢氧化钡 | 蔗糖溶液 | 碱石灰 | 三氧化硫 |
C | 胆矾 | 石灰水 | 苛性钾 | 氨气 |
D | 硫酸 | 铝合金 | 氯化钠 | 氢气 |
A. A B. B C. C D. D