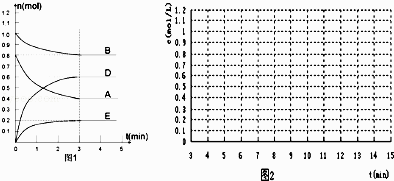
题目内容
【题目】利用氧化还原反应Fe+H2SO4=FeSO4+H2↑设计了一个原电池,如装置图,注明电极名称、反应类型,写出电极反应式。
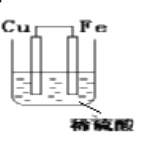
负极(_____):电极反应:___________________________ _________反应
正极(_____):电极反应:___________________________ _________反应
【答案】 Fe Fe-2e-=Fe2+ 氧化反应 Cu 2H++2e-=H2↑ 还原反应
【解析】根据总反应式可知铁失去电子,发生氧化反应。因此负极是铁,电极反应为Fe-2e-=Fe2+;硫酸电离出的氢离子得到电子,发生还原反应,铜的金属性弱于铁,铜是正极,电极反应为2H++2e-=H2↑。

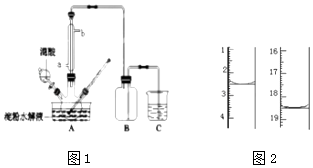
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 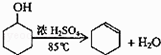
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
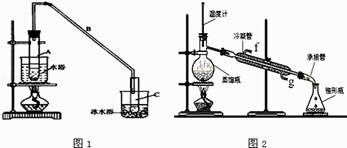
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从口进入,目的是 .
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 . a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.