题目内容
下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
分析:根据碱性溶液里有较多的OH-,利用离子之间不能结合生成水、气体、沉淀、弱电解质,不能发生氧化还原反应、相互促进水解等来分析离子共存,并注意常见离子的颜色.
解答:解:A、碱性条件下该组离子不反应,能大量共存,但MnO4-在水溶液中为紫红色,故A错误;
B、碱性条件下该组离子不反应,能大量共存,且离子在水中都是无色,故B正确;
C、碱性溶液里有较多的OH-,OH-、H+反应生成水,则不能大量共存,故C错误;
D、碱性条件下该组离子不反应,能大量共存,且离子在水中都是无色,故D正确;
故选BD.
B、碱性条件下该组离子不反应,能大量共存,且离子在水中都是无色,故B正确;
C、碱性溶液里有较多的OH-,OH-、H+反应生成水,则不能大量共存,故C错误;
D、碱性条件下该组离子不反应,能大量共存,且离子在水中都是无色,故D正确;
故选BD.
点评:本题考查离子的共存问题,明确信息中碱性、无色是解答的关键,并注意离子之间的反应来分析解答即可,并注意归纳常见的有色的离子来解答此类习题.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
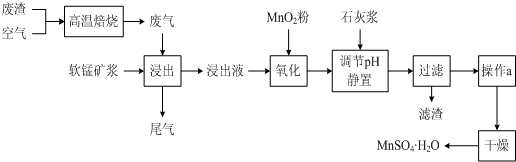
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为______kg.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为______kg.