题目内容
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为______kg.
故答案为:SO2+MnO2=MnSO4;
(2)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可.
故答案为:4.7~8.3;
(4)Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙.
故答案为:氢氧化铁、氢氧化铝、硫酸钙;
(5)a.二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠和二氧化硫、水又能反应生成亚硫酸氢钠,有两步反应,所以无法准确测定尾气中SO2含量,故a错误.
b.稀H2SO4酸化的KMnO4溶液和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故b正确.
c.碘和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故c正确.
d.氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和二氧化硫和水又能反应生成亚硫酸氢铵,有两步反应,所以无法准确测定尾气中SO2含量,故d错误.
故答案为:b、c;
(6)根据硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,所以硫酸锰晶体的质量为
| 6.4g/m3×1000m3×90% |
| 64g/mol |
故答案为:15.21kg.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
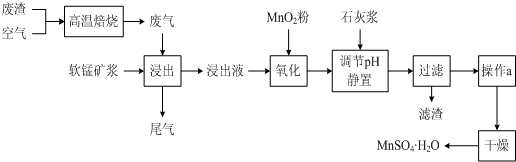
小学生10分钟应用题系列答案为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式: ________________________。
(2)写出氧化过程中主要反应的离子方程式: ______________________。
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是____________。
(4)滤渣的主要成分有_________________________________________。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d.氨水、酚酞试液
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式: ________________________。
(2)写出氧化过程中主要反应的离子方程式:______________________。
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是____________。
(4)滤渣的主要成分有____________________________________
 _____。
_____。(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d. 氨水、酚酞试液
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式: ________________________。
(2)写出氧化过程中主要反应的离子方程式: ______________________。
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是____________。
(4)滤渣的主要成分有_________________________________________。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d. 氨水、酚酞试液

