��Ŀ����
����Ŀ��ͼ��AΪ����ɫ���壬B����������A��ͬ���������ʾ���ȥ����
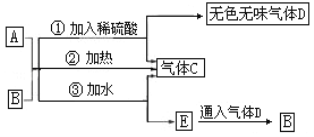
�������Ϲ�ϵ���ش��������⣺
��1��A�ĵ���ʽΪ__________.
��2��AͶ��FeCl2��Һ�еķ�ӦΪ_______________(����һ����ѧ����ʽ��ʾ)
��3����A��B�����ʵ���֮��1:1.5������ܱ������м��ȳ�ַ�Ӧ���ų�����,��ʣ��Ĺ���Ϊ_____________________________(д��ѧʽ)
��4�����ܱ���Ϊ21������߷�չDZ���������Դ���Իش��������⣺
���뻯ʯȼ����ȣ�������Ϊȼ�ϵ��ŵ���__________________(������)��
��ʩ������Sehlesinger�������������NaBH4��ˮ��Ӧ��������д��NaBH4��ˮ��Ӧ�Ļ�ѧ����ʽ____________________________________��
���𰸡�![]() 4Na2O2+4FeCl2+6H2O�T4Fe(OH)3��+8NaCl+O2�� NaOH�� Na2CO3 ��ֵ��,��ȾС NaBH4+2H2O=NaBO2+4H2��
4Na2O2+4FeCl2+6H2O�T4Fe(OH)3��+8NaCl+O2�� NaOH�� Na2CO3 ��ֵ��,��ȾС NaBH4+2H2O=NaBO2+4H2��
��������
ͼ��AΪ����ɫ����ΪNa2O2����ͼ��CΪ����ΪO2�� A��B�ڼ���ϡ�������Ȼ��ˮ���ܲ�������C�����Dͨ��E�ܲ���B��B��ϡ���ᷴӦ���ܲ���D����B����������A��ͬ����BΪNaHCO3������ϡ���ᷴӦ���ɶ�����̼����DΪCO2��A��B��ˮ��Ӧ����EΪNa2CO3���ݴ˴��⡣
ͼ��AΪ����ɫ����ΪNa2O2����ͼ��CΪ����ΪO2�� A��B�ڼ���ϡ�������Ȼ��ˮ���ܲ�������C�����Dͨ��E�ܲ���B��B��ϡ���ᷴӦ���ܲ���D����B����������A��ͬ����BΪNaHCO3������ϡ���ᷴӦ���ɶ�����̼����DΪCO2��A��B��ˮ��Ӧ����EΪNa2CO3��
��1��AΪNa2O2��Na2O2�ĵ���ʽΪ![]() ��
��
��ˣ�������ȷ���ǣ�![]() ��
��
(2) AΪNa2O2������ǿ�����ԣ��ܽ�Fe2+����ΪFe3+������������������������������ͬʱ�������ƺ�ˮ��Ӧ�����������ɣ����ݵ�ʧ�����غ�д������ʽΪ4Na2O2+4FeCl2+6H2O�T4Fe(OH)3��+8NaCl+O2�� ��
��ˣ�������ȷ���ǣ�4Na2O2+4FeCl2+6H2O�T4Fe(OH)3��+8NaCl+O2����
(3)��A��B�����ʵ���֮��1:1.5������ܱ������м��ȳ�ַ�Ӧ���ų����壬���ܷ����ķ�Ӧ�������ʵ����������£�
2NaHCO3![]() Na2CO3 + CO2�� + H2O
Na2CO3 + CO2�� + H2O
1.5mol 0.75mol 0.75mol 0.75mol
2Na2O2+2CO2![]() 2Na2CO3+O2
2Na2CO3+O2
1mol 0.75mol 0.75mol
2Na2O2 + 2H2O![]() 4NaOH+O2��
4NaOH+O2��
(1-0.75)mol 0.75mol 0.5mol
���ݷ�Ӧ��Na2O2+1.5NaHCO3![]() 0.5NaOH + 1.5Na2CO3+ O2������ʣ��Ĺ���ΪNaOH�� Na2CO3��
0.5NaOH + 1.5Na2CO3+ O2������ʣ��Ĺ���ΪNaOH�� Na2CO3��
��ˣ�������ȷ���ǣ�NaOH�� Na2CO3��
(4)�����������Դ������ԭ����Դ�㡢ȼ����ֵ�ߡ���ȾС�����������ŵ㡣
��ˣ�������ȷ���ǣ���ֵ������ȾС��
(5) ��NaBH4��ˮ����������ԭ��Ӧ����NaBO2����������ѧ����ʽΪNaBH4+2H2O=NaBO2+4H2����
��ˣ�������ȷ���ǣ�NaBH4+2H2O=NaBO2+4H2����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�


