题目内容
(2009?福建)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法正确的是( )
分析:根据平衡常数与温度的关系及温度、浓度对平衡的影响来分析解答.
解答:解:A、平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,故A错误;
B、CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,故B正确;
C、因水解是吸热的,则升温可以促进水解,平衡正向移动,
是增大的,故C错误;
D、加入NaOH固体,碱性肯定增强,pH增大,故D错误;
故选:B.
B、CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,故B正确;
C、因水解是吸热的,则升温可以促进水解,平衡正向移动,
| c(HCO3-) |
| c(CO32-) |
D、加入NaOH固体,碱性肯定增强,pH增大,故D错误;
故选:B.
点评:本题考查了水解平衡常数及影响水解平衡的因素.水解平衡常数和化学平衡常数一样是温度的函数,与条件无关.化学平衡移动原理同样适合水解平衡的移动,要多迁移,多联系.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
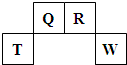 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.

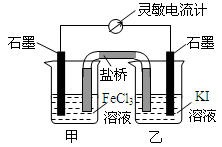 (2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
(2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )