题目内容
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:

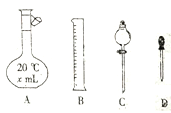
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中__________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气。其目的是_______________________。
(3)装置A的作用是_________,装置E的作用是_____________。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍的化学式为___________。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。
【答案】 c c 不再有气泡产生 将装置中残留的气体产物吹入吸收装置中 吸收空气中的CO2和水蒸气 防止空气中的CO2和水蒸气进入装置D Ni3(OH)4CO3·4H2O 在装置B、C之间连接一个安全瓶
【解析】(l)由于装置中含有空气且需要把生成的气体完全排除,所以需要利用空气把装置中的空气以及生成的气体排尽,但由于空气中含有水蒸气和CO2,所以通入前需要利用碱石灰净化空气;反应中生成的水蒸气用浓硫酸吸收,生成的CO2应该用碱石灰吸收,所以甲、乙两装置均选择碱石灰,答案选c;(2)反应中有水蒸气生成,所以当装置C中不再有气泡产生时,停止加热;打开活塞K,缓缓通入空气,其目的是将装置中残留的气体产物吹入吸收装置中。(3)根据以上分析可知装置A的作用是吸收空气中的CO2和水蒸气,装置E的作用是防止空气中的CO2和水蒸气进入装置D。(4)根据表中数据可知生成的水是1.08g,物质的量是0.06mol。生成的CO2是0.44g,物质的量是0.01mol。固体减少的质量是3.77g-2.25g=1.52g=0.44g+1.08g,这说明反应中反应中的生成物是NiO、H2O和CO2,其中氧化镍是2.25g,物质的量是0.03mol,则x:z=3:1;根据电荷守恒可知2x=y+2z,解得y=4z,即化学式是Ni3(OH)4CO3;其中生成的结晶水的物质的量是0.06mol-0.02mol=0.04mol,因此最终物质的化学式为Ni3(OH)4CO3·4H2O;(5)为防止浓硫酸倒吸入硬质玻璃管中,可以在装置B、C之间连接一个安全瓶。