题目内容
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 .
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 .
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 .
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
考点:原子核外电子排布,键能、键长、键角及其应用
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,据此解答;
(2)①键能越小,化学键越不稳定;
②键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行.
(2)①键能越小,化学键越不稳定;
②键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行.
解答:
解:(1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9、电子数为4,
故答案为:M;9;4;
(2)①由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
故答案为:M;9;4;
(2)①由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
点评:本题考查核外电子排布、化学键等,难度中等,(1)中M能层轨道数目为易错点,学生容易忽略d能级轨道数目,注意键能对物质性质及结构的影响.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
乙酸橙花酯是一种食用香料,结构如图所示a下列有关说法不正确的是( )
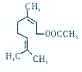

| A、分子式为C12H20O2 |
| B、该化合物存在酚类同分异构体 |
| C、1mol该化合物最多可与2mol H2或1mol NaOH反应 |
| D、该化合物能发生的反应类型有:加成、取代、氧化、聚合 |
邻羟基苯甲酸,俗名水杨酸,其结构简式为 ,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
 ,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )| A、NaCl |
| B、Na2SO4 |
| C、NaOH |
| D、NaHCO3 |
下列对SO2和SO3的叙述正确的是( )
| A、都能跟碱溶液反应 |
| B、都是酸性氧化物,其水溶液都是强酸 |
| C、都可使品红溶液褪色,加热时红色又能再现 |
| D、通常条件下,都是无色气体,都易溶于水 |
 已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.
已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.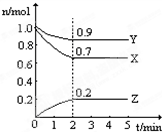 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: