题目内容
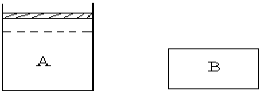 有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的
有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的| 4 |
| 5 |
(1)平衡时A容器中NH3的体积分数是
(2)已知在该温度下:N2(g)+3H2(g)═2NH3(g)△H=-Q kJ/mol.则QA、2QB、Q三者由小到大的顺序为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学平衡三段式列式计算平衡物质的量,依据相同条件下气体物质的量之比等于体积之比,计算氨气的体积分数;
(2)依据可逆反应正向进行的程度判断反应放热的大小;
(2)依据可逆反应正向进行的程度判断反应放热的大小;
解答:
解:(1)一定条件下A容器中1molN2和3mol H2通入到V升的容器中发生反应,设氮气消耗物质的量为x
N2+3H2 2NH3
2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol)1-x 3-3x 2x
依据题意则有
=
,所以x=0.4
则平衡时,氨气的体积分数=
×100%=
×100%=25%,
故答案为25%.
(2)因为 N2+3H2 2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g)
2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g) 2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;
2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;
N2+3H2
 2NH3
2NH3起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol)1-x 3-3x 2x
依据题意则有
| 1-x+3-3x+2x |
| 1+3 |
| 4 |
| 5 |
则平衡时,氨气的体积分数=
| 2x |
| 4-2x |
| 0.8 |
| 3.2 |
故答案为25%.
(2)因为 N2+3H2
 2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g)
2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g) 2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;
2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;
点评:本题考查了化学平衡的计算应用,主要是压强之比等于物质的量之比的计算应用,掌握基础是关键体积,题目难度中等.

练习册系列答案
相关题目
下列反应属于取代反应的是( )
| A、丙烯与氯化氢在一定条件下制取2-氯丙烷 |
| B、酒精与浓硫酸混合液迅速升温至170℃的反应 |
| C、甲烷制四氯化碳 |
| D、甲烷与氧气的混合气体在点燃下的反应 |
化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O;2FeCl2+Cl2═2FeCl3
复分解反应:
2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O;KCN+CO2+H2O═HCN+KHCO3
热分解反应:
4NaClO
3NaCl+NaClO4;NaClO4
NaCl+2O2↑
下列说法不正确是( )
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O;2FeCl2+Cl2═2FeCl3
复分解反应:
2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O;KCN+CO2+H2O═HCN+KHCO3
热分解反应:
4NaClO
| ||
| ||
下列说法不正确是( )
| A、氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
| B、还原性(酸性溶液):FeCl2>HI>HCl |
| C、酸性(水溶液):CH3COOH>H2CO3>HCN |
| D、热稳定性:NaCl>NaClO4>NaClO |
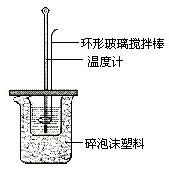 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题 根据中和热的测定实验填空.
根据中和热的测定实验填空.