题目内容
化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O;2FeCl2+Cl2═2FeCl3
复分解反应:
2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O;KCN+CO2+H2O═HCN+KHCO3
热分解反应:
4NaClO
3NaCl+NaClO4;NaClO4
NaCl+2O2↑
下列说法不正确是( )
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O;2FeCl2+Cl2═2FeCl3
复分解反应:
2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O;KCN+CO2+H2O═HCN+KHCO3
热分解反应:
4NaClO
| ||
| ||
下列说法不正确是( )
| A、氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
| B、还原性(酸性溶液):FeCl2>HI>HCl |
| C、酸性(水溶液):CH3COOH>H2CO3>HCN |
| D、热稳定性:NaCl>NaClO4>NaClO |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:A、根据氧化剂的氧化性大于氧化产物的氧化性判断;
B、根据还原剂的还原性大于还原产物的还原性来判断,在反应物中作还原剂的是该反应中所有物质中还原性最强的;
C、根据化学反应遵循强酸制弱酸的规律来判断;
D、根据物质分解时生成更加稳定的物质来判断;
B、根据还原剂的还原性大于还原产物的还原性来判断,在反应物中作还原剂的是该反应中所有物质中还原性最强的;
C、根据化学反应遵循强酸制弱酸的规律来判断;
D、根据物质分解时生成更加稳定的物质来判断;
解答:
解:A、在2FeCl3+2HI═2FeCl2+I2+2HCl反应中,氧化性:FeCl3>I2,在2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O中,氧化性:Co(OH)3>Cl2,又Cl2>FeCl3,则Co(OH)3>FeCl3,则有:Co(OH)3>FeCl3>I2,故A不选;
B、在 3I2+6KOH═5KI+KIO3+3H2O反应中,I2既是氧化剂又是还原剂,其还原性介于高低价态产物之间KI>I2>KIO3;在2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI反应中,反应物中作还原剂的是该反应中所有物质中还原性最强的,即Fe(OH)2>I2;Fe(OH)2>Fe(OH)3;Fe(OH)2>KI,故还原性应为:Fe(OH)2>I2>KIO3,故B选;
C、化学反应遵循强酸制弱酸的规律,在反应2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O中,酸性CH3COOH>H2CO3,在反应中KCN+CO2+H2O═HCN+KHCO3,酸性H2CO3>HCN,则酸性为CH3COOH>H2CO3>HCN,故C不选;
D、物质分解时生成更加稳定的物质,在反应中4NaClO
3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4
NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故D不选;
故选B.
B、在 3I2+6KOH═5KI+KIO3+3H2O反应中,I2既是氧化剂又是还原剂,其还原性介于高低价态产物之间KI>I2>KIO3;在2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI反应中,反应物中作还原剂的是该反应中所有物质中还原性最强的,即Fe(OH)2>I2;Fe(OH)2>Fe(OH)3;Fe(OH)2>KI,故还原性应为:Fe(OH)2>I2>KIO3,故B选;
C、化学反应遵循强酸制弱酸的规律,在反应2CH3COOH+K2CO3═2CH3COOK+CO2↑+H2O中,酸性CH3COOH>H2CO3,在反应中KCN+CO2+H2O═HCN+KHCO3,酸性H2CO3>HCN,则酸性为CH3COOH>H2CO3>HCN,故C不选;
D、物质分解时生成更加稳定的物质,在反应中4NaClO
| ||
| ||
故选B.
点评:本题考查氧化性、还原性、稳定性和酸性的比较,做题时注意积累比较物质的性质的规律和方法.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、聚丙烯的结构简式为: |
B、丙烷分子的球棍模型为: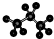 |
C、四氯化碳分子的电子式为: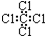 |
| D、乙烯的结构简式:CH2CH2 |
如图所示的实验操作和方法不是用来分离物质的是( )
A、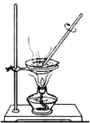 |
B、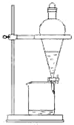 |
C、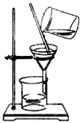 |
D、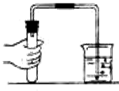 |
下列有关化学反应速率的说法不正确的是( )
| A、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| B、催化剂能降低化学反应的活化能,加快反应速率,提高生产效率 |
| C、用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 |
| D、化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
某烯烃跟氢气起加成反应的产物是2,2,3,4-四甲基戊烷,这样的单烯烃可能有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列化学用语表示正确的是( )
| A、HClO、KOH的结构式都可用X-Y-Z表示 |
B、O2-、Mg2+的结构中能量最高电子层的轨道表示式都可以用图表示: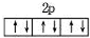 |
C、甲烷、四氯化碳的分子构型相似,均可以表示为: |
| D、分子式中n(C):n(H)=n:(2n+2)的物质不一定是烷烃 |
下列说法正确的是( )
| A、丙炔分子中三个碳原子位于同一直线上 |
| B、丙烯与HCl加成只生成一种产物 |
| C、1mol丙烷在光照情况下,最多消耗4mol氯气 |
| D、丙烷中混有丙烯可用H2加热方法除去 |
下列有机化合物中沸点最低的是( )
| A、乙酸乙酯 | B、乙酸丁酯 |
| C、丁醇 | D、乙酸 |
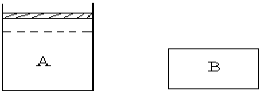 有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的
有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的