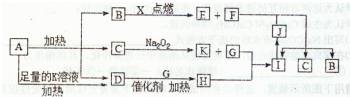
题目内容
(2011?唐山模拟)下列溶液中离子浓度的关系一定正确的是( )
分析:A.(NH4)2SO4溶液中c(NH4+)>c(SO42-);
B.由于酸碱的强弱不确定,则反应后溶液不一定为中性;
C.根据盐的水解,越弱越水解的原理比较溶液浓度大小;
D.从物料守恒的角度分析.
B.由于酸碱的强弱不确定,则反应后溶液不一定为中性;
C.根据盐的水解,越弱越水解的原理比较溶液浓度大小;
D.从物料守恒的角度分析.
解答:解:A.(NH4)2SO4溶液中,水解程度较小,则应有c(NH4+)>c(SO42-),水解显酸性,则c(H+)>c(OH-),故A错误;
B.由于酸碱的强弱不确定,则反应后溶液不一定为中性,故B错误;
C.由于CH3COONa、C6H5ONa、Na2CO3对应的酸分别是CH3COOH,C6H5OH(不是酸,显弱酸性),HCO3-,其酸为CH3COOH>C6H5OH>HCO3-.根据盐的水解,越弱越水解的原理,所以在pH相同的情况下应是:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3),故C错误;
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中,根据元素守恒可知n(X)=n(K),则有c(K+)=c(H2X)+c(HX-)+c(X2-),故D正确.
故选D.
B.由于酸碱的强弱不确定,则反应后溶液不一定为中性,故B错误;
C.由于CH3COONa、C6H5ONa、Na2CO3对应的酸分别是CH3COOH,C6H5OH(不是酸,显弱酸性),HCO3-,其酸为CH3COOH>C6H5OH>HCO3-.根据盐的水解,越弱越水解的原理,所以在pH相同的情况下应是:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3),故C错误;
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中,根据元素守恒可知n(X)=n(K),则有c(K+)=c(H2X)+c(HX-)+c(X2-),故D正确.
故选D.
点评:本题考查溶液中离子的浓度的比较,明确物质的化学式及水解、电离是解答本题的关键,并注意溶液中的溶质及其物质的量的关系、水解及抑制水解的因素等来解答.

练习册系列答案
相关题目
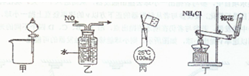 (2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )
(2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )