题目内容
| |||||||||||||||||||||||||||||||||||
解析:
(1) |
(1)I. (2)防止乙醇挥发 |
(4) |
CH3CH2OH+6H2SO4 |
(5) |
(1)NaOH(合理就给分) (2)乙醇(CH3CH2OH) |

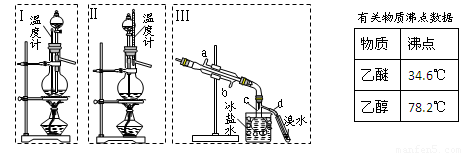
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择 (选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是 .
(2)Ⅲ中水冷凝管的进水口是 (选答“a”或“b”).冰盐水的作用是 .
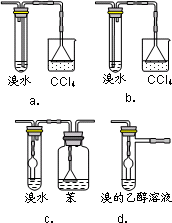
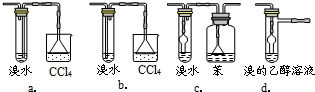
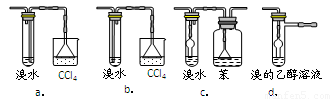
(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号) .

(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式 .
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是 .
②蒸馏操作可除去的杂质是 .
(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号) .
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液.