题目内容
(2012?浦东新区二模)乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用如图装置制取乙醚和乙烯.

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
(2)Ⅲ中水冷凝管的进水口是
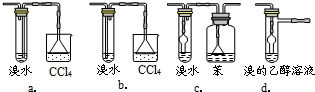
(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)
(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是
②蒸馏操作可除去的杂质是
(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液.
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择
Ⅰ
Ⅰ
(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
防止乙醇挥发
防止乙醇挥发
.(2)Ⅲ中水冷凝管的进水口是
b
b
(选答“a”或“b”).冰盐水的作用是冷凝液化乙醚
冷凝液化乙醚
.(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)
c、d
c、d
.
(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式
CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O
| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O
.| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是
NaOH
NaOH
.②蒸馏操作可除去的杂质是
乙醇(CH3CH2OH)
乙醇(CH3CH2OH)
.(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)
b、d
b、d
.a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液.
分析:(1)制取乙醚的温度是混合液的温度为140℃;
(2)乙醇具有挥发性,根据乙醇的性质来确定实验目的;
(3)根据气压原理和重力原理来选择防止倒吸的装置;
(4)乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,会将乙醇氧化为二氧化碳或是碳单质等;
(5)①和酸性物质可以反应的是碱液;
②蒸馏可以将沸点不同的物质进行分离;
(6)具有还原性的物质可以和氧化剂过氧化物发生反应,乙醚是难溶于水的物质.
(2)乙醇具有挥发性,根据乙醇的性质来确定实验目的;
(3)根据气压原理和重力原理来选择防止倒吸的装置;
(4)乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,会将乙醇氧化为二氧化碳或是碳单质等;
(5)①和酸性物质可以反应的是碱液;
②蒸馏可以将沸点不同的物质进行分离;
(6)具有还原性的物质可以和氧化剂过氧化物发生反应,乙醚是难溶于水的物质.
解答:解:(1)制取乙醚的温度是控制混合液的温度为140℃,温度计的水银球要插在液面以下,故选装置Ⅰ,故答案为:Ⅰ;
(2)乙醇具有挥发性,要通过分液漏斗下端连接的长导管插入到液面下加入,故答案为:防止乙醇挥发;
(3)c、d是可以防止倒吸的装置,并且可以实现乙醚的分离,a中不能将溴乙烷和乙醚分离开来,b装置会导致倒吸现象,故选c、d;
(4)乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,浓硫酸的强氧化性会将乙醇氧化为二氧化碳或是碳单质等,发生的化学反应有:CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O,故答案为:CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O;
(5)①分液步骤除去产品中的酸性杂质可以用碱液,如氢氧化钠,故答案为:NaOH;
②蒸馏可以将沸点不同的物质进行分离,乙醇的沸点较低,可用蒸馏的方法除去乙醚中的乙醇,故答案为:乙醇(CH3CH2OH);
(6)具有还原性的物质亚硫酸钠、酸化的FeSO4溶液可以和氧化剂过氧化物发生反应,生成硫酸钠、硫酸铁的水溶液,而乙醚是难溶于水的物质,可以分层,再分液即可分离,故答案为:b、d.
(2)乙醇具有挥发性,要通过分液漏斗下端连接的长导管插入到液面下加入,故答案为:防止乙醇挥发;
(3)c、d是可以防止倒吸的装置,并且可以实现乙醚的分离,a中不能将溴乙烷和乙醚分离开来,b装置会导致倒吸现象,故选c、d;
(4)乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,浓硫酸的强氧化性会将乙醇氧化为二氧化碳或是碳单质等,发生的化学反应有:CH3CH2OH+6H2SO4
| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
(5)①分液步骤除去产品中的酸性杂质可以用碱液,如氢氧化钠,故答案为:NaOH;
②蒸馏可以将沸点不同的物质进行分离,乙醇的沸点较低,可用蒸馏的方法除去乙醚中的乙醇,故答案为:乙醇(CH3CH2OH);
(6)具有还原性的物质亚硫酸钠、酸化的FeSO4溶液可以和氧化剂过氧化物发生反应,生成硫酸钠、硫酸铁的水溶液,而乙醚是难溶于水的物质,可以分层,再分液即可分离,故答案为:b、d.
点评:本题重点考查学生乙醇的化学性质,结合实验考查增加了试题的难度,综合性强,要求学生具有分析和解决问题的能力.

练习册系列答案
相关题目