题目内容
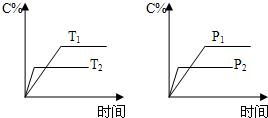 可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )分析:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象可知T2>T1,温度越高,平衡时C的百分含量(C%)越小,故此反应的正反应为放热反应;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图象可知p2>p1,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动;
B、温度升高,化学平衡向吸热方向移动;
C、压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d;
D、A为固体,达到平衡后,增加A平衡不移动.
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图象可知p2>p1,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动;
B、温度升高,化学平衡向吸热方向移动;
C、压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d;
D、A为固体,达到平衡后,增加A平衡不移动.
解答:解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象可知T2>T1,温度越高,平衡时C的百分含量(C%)越小,故此反应的正反应为放热反应;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图象可知p2>p1,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动,C的百分含量C%不变,故A错误;
B、由上述分析可知,可逆反应aA(s)+bB(g)?c C(g)+d D(g)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应aA(s)+bB(g)?c C(g)+d D(g)正反应为气体物质的量增大的反应,即b<c+d,故C错误;
D、增大固体物质的物质的量不能使平衡移动,A为固体,达到平衡后,增加A平衡不移动,故D错误.
故选B.
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图象可知p2>p1,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即b<c+d.
A、加入催化剂同等程度增大正逆反应速率,平衡不移动,C的百分含量C%不变,故A错误;
B、由上述分析可知,可逆反应aA(s)+bB(g)?c C(g)+d D(g)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应aA(s)+bB(g)?c C(g)+d D(g)正反应为气体物质的量增大的反应,即b<c+d,故C错误;
D、增大固体物质的物质的量不能使平衡移动,A为固体,达到平衡后,增加A平衡不移动,故D错误.
故选B.
点评:本题考查了体积分数随温度、压强变化曲线的分析,难度不大,明确“先拐先平数值大”是解本题的关键,注意D选项中,固体量的多少对化学平衡无影响,即不影响平衡的移动,也不影响其它气体的转化率.

练习册系列答案
相关题目
可逆反应aA(s)+bB(g)?cC(g)+dD(g);△H═Q KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是( )
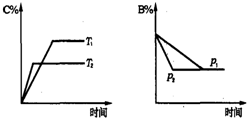

| A、T1<T2,Q>0 | B、Pl<P2,b═c+d | C、Tl>T2,Q<0 | D、P1<P2,a+b═c+d |
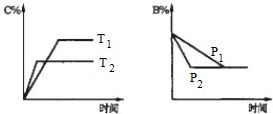 可逆反应aA(s)+bB(g)?cC(g)+dD(g)△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是( )| A、T1>T2,Q>0 | B、Tl<T2,Q>0 | C、P1>P2,a+b=c+d | D、Pl<P2,b=c+d |
 可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )