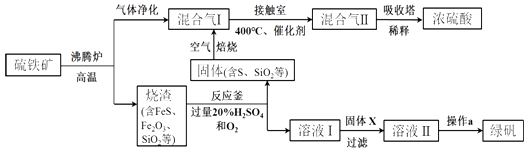
题目内容
【题目】室温下,0.1mol/L的H2A溶液体系中,含A粒子的分布系数(平衡时某粒子的浓度占各粒子浓度之和的分数)与溶液 pH的关系如图所示.下列说法不正确的是( ) 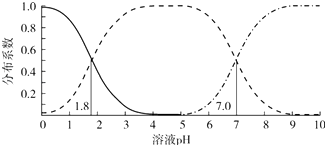
A.室温下,HA﹣的电离常数Ka2=1.0×10﹣7
B.室温下,0.1mol/L的NaHA溶液显酸性
C.室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液pH=1.8
D.0.1mol/L的Na2A溶液中c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A)
【答案】C
【解析】解:根据图知,pH为0﹣4时,实线表示H2A、虚线表示HA﹣ , pH=4﹣5虚线表示HA﹣ , pH>5时,下降的虚线表示HA﹣ , 上升的虚线表示A2﹣ , A.室温下,pH=7时,c(A2﹣)=c(HA﹣),HA﹣的电离常数Ka2= ![]() =1.0×10﹣7 , 故A正确;
=1.0×10﹣7 , 故A正确;
B.根据图知,pH=4﹣5时,溶液中阴离子主要是HA﹣ , 溶液pH接近4﹣5,溶液呈酸性,故B正确;
C.室温下,0.2mol/L的 H2A与0.1mol/L的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaHA、H2A,但是H2A部分电离,所以溶液中两种阴离子浓度不等,则溶液的pH不等于1.8,故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(HA﹣)+2c(A2﹣)+c(OH﹣),根据物料守恒得c(Na+)=2[c(HA﹣)+c(A2﹣)+c(H2A)],所以得c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A),故D正确;
故选C.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目