题目内容
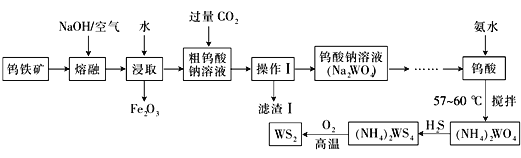
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
请回答下列问题:
(1)已知:W元素的原子序数是74,请写出W元素在周期表中的位置:_________________
(2)操作Ⅰ中用到的玻璃仪器有________________________________
(3)写出FeWO4在碱熔过程中发生反应的化学方程式:_________________________________
(4)滤渣Ⅰ中主要成分的形成可用离子方程式表示为:_________________________________
(5)钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,其原理为:W(s)+2I2(g)![]() WI4(g)下列说法正确的有_______
WI4(g)下列说法正确的有_______
A. 灯管内的I2可以循环使用
B. WI4在灯丝上分解,产生的W又在灯丝上沉积
C. 温度升高时,WI4的分解速率加快,而W和I2的合成速率减慢
D. WI4在灯管壁上分解,使灯管寿命延长
(6)已知常温下,Ksp(CaWO4) =1×10-10,浓度为x mol/L的Na2WO4溶液与浓度为1×10-4 mol/L的CaCl2溶液按体积比2:1混合,产生CaWO4沉淀,则x≥___________
(7)已知生成二硫化钨的化学方程式为:2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
【答案】 第六周期,ⅥB族 玻璃棒、漏斗、烧杯 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O AlO
2Fe2O3+4Na2WO4+4H2O AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() AB 4.5×10-6 4NA(或2.408×1024)
AB 4.5×10-6 4NA(或2.408×1024)
【解析】考查化学工艺流程,(1)W元素的原子序数为74,因此W元素位于第六周期VIB族;(2)操作I得到溶液和滤渣,此操作方法是过滤,用到的玻璃仪器是(普通)漏斗、烧杯、玻璃棒;(3)根据流程图,FeWO4在碱熔中,得到Fe2O3和Na2WO4,反应物是NaOH、FeWO4、NaOH,生成物是Na2WO4、Fe2O3,FeWO4中Fe显+3价,W显+5价,Na2WO4中W显+6价,FeWO4为还原剂,O2为氧化剂,因此根据化合价升降法,进行配平,因此化学反应方程式为:4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O;(4)根据钨铁矿含有成分中有氧化铝,氧化铝为两性氧化物,碱熔中发生Al2O3+2NaOH
2Fe2O3+4Na2WO4+4H2O;(4)根据钨铁矿含有成分中有氧化铝,氧化铝为两性氧化物,碱熔中发生Al2O3+2NaOH![]() 2NaAlO2+H2O,粗钨酸钠溶液中通入过量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤渣I为氢氧化铝;(5)A、根据原理,此反应是可逆反应,因此灯管内的I2可以循环使用,故A正确;B、钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,WI4在灯丝上分解,产生的W又在灯丝上沉积,故B正确;C、温度升高,正逆反应速率都加快,故C错误;D、根据B选项分析,故D错误;(6)根据Qc与Ksp的关系,有c(WO42-)×c(Ca2+)≥Ksp(CaWO4),代入数值,得出:
2NaAlO2+H2O,粗钨酸钠溶液中通入过量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤渣I为氢氧化铝;(5)A、根据原理,此反应是可逆反应,因此灯管内的I2可以循环使用,故A正确;B、钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,WI4在灯丝上分解,产生的W又在灯丝上沉积,故B正确;C、温度升高,正逆反应速率都加快,故C错误;D、根据B选项分析,故D错误;(6)根据Qc与Ksp的关系,有c(WO42-)×c(Ca2+)≥Ksp(CaWO4),代入数值,得出: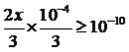 ,解得x≥4.5×10-6mol·L-1;(7)根据反应方程式,W的化合价由+6价→+4价,O2中O的化合价由0价→-2价,S的化合价由-2价→0价、+4价,生成WS2的物质的量为124/248mol=0.5mol,根据反应方程式,求出生成S的物质的量为0.5mol,SO2的物质的量为0.5mol,因此转移电子物质的量为(0.5×2+0.5×6)mol=3mol,转移电子的数目为4NA。
,解得x≥4.5×10-6mol·L-1;(7)根据反应方程式,W的化合价由+6价→+4价,O2中O的化合价由0价→-2价,S的化合价由-2价→0价、+4价,生成WS2的物质的量为124/248mol=0.5mol,根据反应方程式,求出生成S的物质的量为0.5mol,SO2的物质的量为0.5mol,因此转移电子物质的量为(0.5×2+0.5×6)mol=3mol,转移电子的数目为4NA。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案