题目内容
下图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略)。

以下判断不正确的是
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
D.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂

以下判断不正确的是
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
D.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂
D
试题分析:A、AlCl3既可以与强碱反应,也可以与弱碱反应,如NH3?H2O、NaOH,都能生成Al(OH)3,正确;B、若A是碱性气体,为NH3,可以与酸生成铵盐,为非氧化还原反应,也可以与O2、Cl2等发生氧化还原反应,正确;C、A可以是酸、碱、盐,通过复分解反应相互转化,也可以是单质或氧化物,通过氧化还原反应相互转化,正确;D、C或D可能既不作氧化剂也不作还原剂,例如:Na2O2与CO2或H2O的反应,错误。

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目



 Na2SiO3
Na2SiO3 H2SiO3 ②Fe
H2SiO3 ②Fe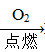 Fe2O3
Fe2O3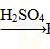 Fe2(SO4)3
Fe2(SO4)3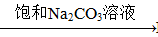 BaCO3
BaCO3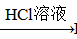 BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)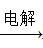 Al
Al HCOOH
HCOOH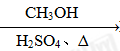 HCOOCH3
HCOOCH3