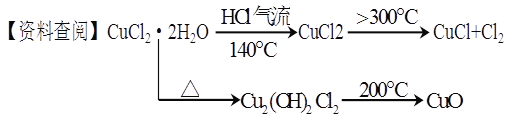题目内容
【题目】固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成,取一定量的固体甲进行如下实验:
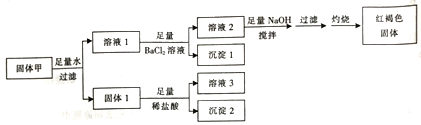
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g。下列说法正确的是
A. 溶液1加入KSCN溶液呈红色
B. 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl
C. 固体1与稀盐酸反应时还生成了标准状祝下气体1.12L
D. 沉淀2不溶于任何酸溶液
【答案】C
【解析】本题考查元素化合物知识,为高频考点,侧重于学生的分析,计算和实验能力的考查,注意把握物质的性质以及反应的现象,为解答该类题目的关键,难度不大。
FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中碳酸钙二氧化硅都不溶于水,加入盐酸,碳酸钙溶解,可知二氧化硅的质量为6克,碳酸钙的质量为11-6=5克,溶液1加入足量氯化钡生成沉淀1为硫酸钡沉淀,溶液2加入足量氢氧化钠溶液最终得到红褐色固体,红褐色固体为氢氧化铁,可知含有硫酸亚铁和硫酸铁中的至少一种,不含硫酸铜。A.如只含有硫酸亚铁,则加入硫氰化钾不变色,故错误;B.因加入氯化钡,引入氯离子,不能确定原固体是否含有氯化钠,故错误;C.由以上分析可知固体1中含有5克碳酸钙,则其物质的量为0.05mol,可生成0.05mol二氧化碳,体积在标况下为1.12L,故正确;D.沉淀2为二氧化硅,可溶于氢氟酸,故错误。故选C。

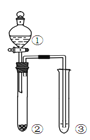
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
【题目】如图表示的一些物质或概念之间的从属关系不正确的是( )
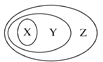
X | Y | Z | |
例 | 氧化物 | 化合物 | 纯净物 |
A | 含氧酸 | 酸 | 化合物 |
B | 溶液 | 分散系 | 混合物 |
C | 强电解质 | 电解质 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D