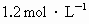题目内容
下列有关阿伏加德罗常数(NA)的说法正确的有
- A.在常温常压下,11.2L氯气所含的原子数目为NA
- B.0.1molNa2O2与H2O反应转移电子数为0.1NA
- C.0.1mol/L的100mlCH3COOH溶液中,含有的离子数约为0.02NA
- D.3.2gCu与10.0g98%的H2SO4充分反应可得0.05NA个SO2气体分子
B
分析:A、在常温常压下,Vm≠22.4L/mol;
B、由2Na2O2+2H2O═4NaOH+O2↑可知2mol过氧化钠反应,转移的电子数为2NA;
C、CH3COOH为弱酸,不能完全电离;
D、由Cu+2H2SO4 CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析.
CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析.
解答:A、因常温常压下,Vm≠22.4L/mol,则11.2L氯气的物质的量不是0.5mol,则原子数不等于NA,故A错误;
B、由2Na2O2+2H2O═4NaOH+O2↑可知2mol过氧化钠反应,转移的电子数为2NA,则0.1molNa2O2与H2O反应转移电子数为
0.1NA,故B正确;
C、CH3COOH的物质的量为0.1mol/L×0.1L=0.01mol,但醋酸不能完全电离,则离子数远远小于0.02NA,故C错误;
D、Cu的物质的量为0.05mol,硫酸的物质的量为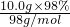 =0.1mol,由Cu+2H2SO4
=0.1mol,由Cu+2H2SO4 CuSO4+SO2↑+2H2O可知,若完全反应则得0.05NA个SO2气体分子,但随反应的进行,浓硫酸变为稀硫酸,且稀硫酸不与Cu反应,所以SO2气体分子的数目一定小于0.05NA,故D错误;
CuSO4+SO2↑+2H2O可知,若完全反应则得0.05NA个SO2气体分子,但随反应的进行,浓硫酸变为稀硫酸,且稀硫酸不与Cu反应,所以SO2气体分子的数目一定小于0.05NA,故D错误;
故选B.
点评:本题考查有关阿伏伽德罗常数的计算,明确发生的化学反应、反应中转移的电子数、强弱电解质、气体所处的状况是解答本题的关键.
分析:A、在常温常压下,Vm≠22.4L/mol;
B、由2Na2O2+2H2O═4NaOH+O2↑可知2mol过氧化钠反应,转移的电子数为2NA;
C、CH3COOH为弱酸,不能完全电离;
D、由Cu+2H2SO4
 CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析.
CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析.解答:A、因常温常压下,Vm≠22.4L/mol,则11.2L氯气的物质的量不是0.5mol,则原子数不等于NA,故A错误;
B、由2Na2O2+2H2O═4NaOH+O2↑可知2mol过氧化钠反应,转移的电子数为2NA,则0.1molNa2O2与H2O反应转移电子数为
0.1NA,故B正确;
C、CH3COOH的物质的量为0.1mol/L×0.1L=0.01mol,但醋酸不能完全电离,则离子数远远小于0.02NA,故C错误;
D、Cu的物质的量为0.05mol,硫酸的物质的量为
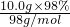 =0.1mol,由Cu+2H2SO4
=0.1mol,由Cu+2H2SO4 CuSO4+SO2↑+2H2O可知,若完全反应则得0.05NA个SO2气体分子,但随反应的进行,浓硫酸变为稀硫酸,且稀硫酸不与Cu反应,所以SO2气体分子的数目一定小于0.05NA,故D错误;
CuSO4+SO2↑+2H2O可知,若完全反应则得0.05NA个SO2气体分子,但随反应的进行,浓硫酸变为稀硫酸,且稀硫酸不与Cu反应,所以SO2气体分子的数目一定小于0.05NA,故D错误;故选B.
点评:本题考查有关阿伏伽德罗常数的计算,明确发生的化学反应、反应中转移的电子数、强弱电解质、气体所处的状况是解答本题的关键.

练习册系列答案
相关题目
 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关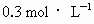 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是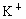
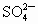 总数为0.9
总数为0.9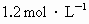
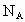 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关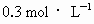 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是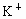
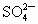 总数为0.9
总数为0.9