题目内容
【题目】研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验: 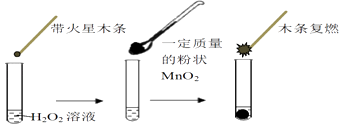
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如表:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 .
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1molL﹣1FeCl3 | 5滴0.1molL﹣1 CuCl2 | 5滴0.3molL﹣1 NaCl |
产生气 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 , 实验Ⅲ的目的是 .
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 .
【答案】
(1)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(2)在一定质量范围内,增加MnO2的质量,化学反应速率加快
(3)Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好;对比实验,说明Cl﹣对的H2O2分解没有催化效果
(4)2FeCl2+H2O2+2HCl═2FeCl3+2H2O
【解析】解:(1)H2O2在MnO2催化作用下分解生成水和氧气,反应的方程式为:2H2O2 ![]() 2H2O+O2↑,
2H2O+O2↑,
所以答案是:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(2.)根据表格中数据,在一定质量范围内,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,原因是在一定质量范围内,固体质量越大,其表面积也越大,故反应速率加快,催化效果更好;
所以答案是:在一定质量范围内,MnO2质量越大,反应速率越快;
(3.)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl﹣对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,
所以答案是:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl﹣对H2O2的分解没有催化作用;
(4.)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
所以答案是:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.

【题目】A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示。
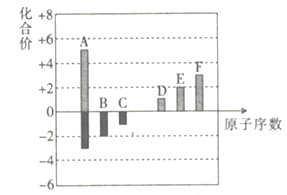
(1)将A、E两种元素的元素符号填入下表中正确的位置上。________
族序数 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ||||||||
三 | ||||||||
(2)A、B、C、D、E、F六种元素中非金属性最强的是____________(填元素符号),B、D两元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式:______,A、B两元素对应的气态氢化物的稳定性强弱关系是________________(用化学式表示)。
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:________________________

