题目内容
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:
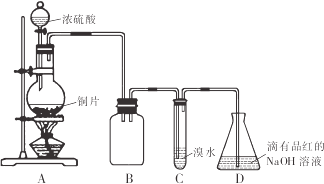
(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
【答案】
(1)bc(2分)
(2)防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;(4分)
(3)(4分)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | Ⅰ或Ⅱ | ||
② | 溶液变为蓝色 | ||
③ | 溴水褪色 | ||
④ | Ⅰ或Ⅲ |
【解析】由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气。
(1)某同学认为H2SO4也有剩余,则可以检验H+或测定稀硫酸的pH确定稀硫酸的存在;烧瓶中存在硫酸铜和硫酸,若用中和滴定法其中的硫酸铜也会消耗碱,达不到目的;同理加入足量的氯化钡,其中的硫酸铜也会消耗氯化钡,同样不能达到目的。故答案为:b c;
(2)装置B的作用是防倒吸(或安全瓶),C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-。装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,故答案为:防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)①加入几小块CaCO3固体,生成CO2气体,溶液显酸性,可能是Ⅰ或Ⅱ;②如果你漂白粉过量,发生反应NaHSO3+Ca(ClO)2═CaSO4↓+NaCl+HClO,次氯酸氧化碘离子为碘单质,碘遇淀粉变蓝,溶液变为蓝色;③如果你漂白粉不足,溴水被NaHSO3溶液还原,溴水褪色;④如果HSO3-与ClO-刚好反应完,方程式为2NaHSO3+Ca(ClO)2+CaCl2═2CaSO4↓+2NaCl+2HCl,滴入加少量酸性KMnO4溶液,溶液显紫色,说明没有还原性物质,反应可能是Ⅰ或Ⅲ;故答案为:①Ⅰ或Ⅱ;②溶液变为蓝色;③溶液褪色;④Ⅰ或Ⅲ;

 发散思维新课堂系列答案
发散思维新课堂系列答案