题目内容
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是
①C2H2与C2H4O ②C4H8与C6H12O6③C7H8与C6H12④HCOOCH3与CH3COOH
A. ①③④ B. ①②③④ C. ①④ D. ①②④
【答案】B
【解析】试题分析:有机物燃烧的方程式为CnHmOz+(n+m/4—z/2)O2=nCO2+m/2H2O,所以在有机物物质的量相等的条件下消耗氧气的多少只与(n+m/4—z/2)有关系,(n+m/4—z/2)越大消耗的氧气越多。则根据有机物的分子式可知①中分别是2.5、2.5,②中分别是6、6,③中分别是9、9,④中分别是2、2,答案选B。

 优学名师名题系列答案
优学名师名题系列答案【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氯化铜 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氧化铝 | 碳酸钠 |
A.A
B.B
C.C
D.D
【题目】下列有关实验现象和解释或结论都正确的选项是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
A. A B. B C. C D. D
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
4FeS2+11O2![]() 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2![]() 2Fe2O3+4SO2
2Fe2O3+4SO2
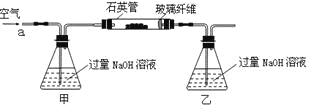
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
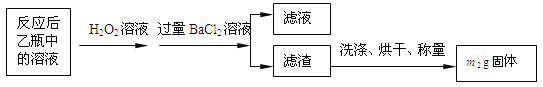
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______________(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
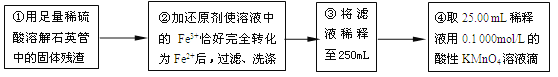
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。