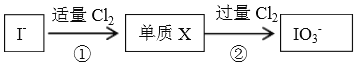
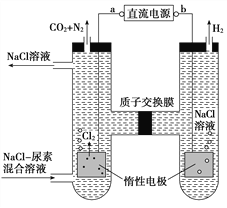
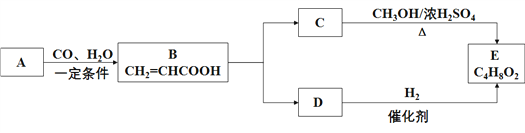
题目内容
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。

乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:测得 0.1 mol·L-1 的HA溶液的pH ______1(填“>”、“<”或“=”);
(3)乙同学设计的方案二能证明改变条件,弱电解质电离平衡发生移动。乙同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(4)若从水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
【答案】 B > NaA固体(或其他合理答案) 物质的量浓度大于0.1 mol·L-1的HA溶液(或其他合理答案) 配制NaA溶液,在常温下测其pH,若pH>7,即证明HA是弱电解质(或其他合理答案)
【解析】本题考查实验方案设计与评价,(1)A、盐酸为强酸,加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大,说明HA为强酸,故A错误;B、加入HA溶液后,试管上方的气球鼓起慢,说明HA溶液中H+的量少,即HA部分发生电离,HA为弱酸,故B正确;C、加入稀盐酸后,试管上方的气球鼓起慢,不能说明HA为弱酸,故C错误;(2)HA为弱电解质,部分电离,因此0.1mol·L-1HA溶液中c(H+)<0.1mol·L-1,即pH>1;(3)①HA的电离方程式为HA![]() H++A-,加入试剂后电离程度减小、c(H+)减小,说明平衡向逆反应方向移动,但c(A-)增大,即加入的物质为NaA;②电离程度减小,c(H+)、c(A-)都增大,说明加入物质为物质的量浓度>0.1mol·L-1的HA溶液;(4)配制NaA溶液,在常温下测其pH,若pH>7,即证明HA是弱电解质。
H++A-,加入试剂后电离程度减小、c(H+)减小,说明平衡向逆反应方向移动,但c(A-)增大,即加入的物质为NaA;②电离程度减小,c(H+)、c(A-)都增大,说明加入物质为物质的量浓度>0.1mol·L-1的HA溶液;(4)配制NaA溶液,在常温下测其pH,若pH>7,即证明HA是弱电解质。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案