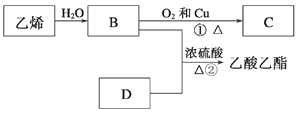
题目内容
【题目】实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO![]() -2e-=PbSO4,正极:PbO2+4H++SO
-2e-=PbSO4,正极:PbO2+4H++SO![]() +2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 molB.0.050 mol
C.0.10 molD.0.20 mol
【答案】C
【解析】
根据电解过程中转移电子守恒找出氯气和硫酸的关系式,根据氯气计算硫酸的消耗量。
设生成0.050摩氯气需转移的电子为x,则
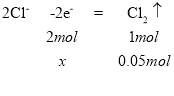
解得x=0.1
放电时,铅蓄电池的电池反应式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据方程式可知每消耗2mol硫酸转移2mol电子,则消耗硫酸 0.1mol,故答案为C。

练习册系列答案
相关题目