题目内容
【题目】现将定量的H2O与足量碳在体积可变的恒压密闭容器中发生反应:
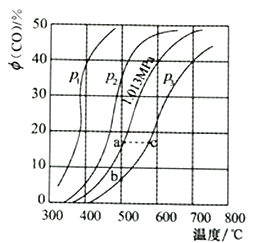
C(s)+H2O (g) ![]() CO(g)+H2(g)△H,测得压强、温度对CO的平衡组成的影响如图所示。
CO(g)+H2(g)△H,测得压强、温度对CO的平衡组成的影响如图所示。
(1)已知:2H2 (g)+O2(g)==2H2O (g) △H1
2CO(g)+ O2 (g)==2CO2(g)△H2
C(s)+ O2 (g)==CO2(g) △H3
则△H=_________(用含△H1、△H2、△H3的式子表示)。
(2)①下列措施能够提高H2产率的是_______(填标号)
a.加压 b.分离出CO C.加热 d.增大碳固体的量
②a、b、c三点所对应的水的转化率最小的是______________。
(3)700℃、P3时,将1molH2O与足量碳充入初始体积为1L的密闭容器中,恒温、恒压条件下,当反应进行到10min时,测得容器中H2的物质的量为0.12mol。
①10min内CO的平均反应速率为__________________ mol·L-1·min-1(保留两位有效数字)。
②此温度下该反应的平衡常数K___________。
③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线。___________________
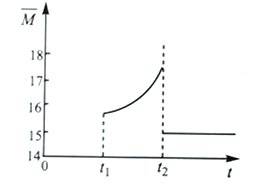
④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是____________________________________________。
【答案】 △H3-1/2△H1-1/2△H2 bc b 0.011 0.8  (起点必须
(起点必须![]() =18开始) 压强增大,水蒸气液化
=18开始) 压强增大,水蒸气液化
【解析】(1)已知:①2H2 (g)+O2(g)==2H2O (g) △H1;②2CO(g)+ O2 (g)==2CO2(g)△H2;③C(s)+ O2 (g)==CO2(g) △H3;根据盖斯定律,由③-![]() ×①-
×①-![]() ×②得反应C(s)+H2O (g)
×②得反应C(s)+H2O (g) ![]() CO(g)+H2(g) △H=△H3-
CO(g)+H2(g) △H=△H3-![]() △H1-
△H1-![]() △H2;(2)①由图中信息可知,升高温度,CO的体积分数增大,则正反应为吸热反应,反应C(s)+H2O (g)
△H2;(2)①由图中信息可知,升高温度,CO的体积分数增大,则正反应为吸热反应,反应C(s)+H2O (g) ![]() CO(g)+H2(g)为气体体积增大的吸热反应。a.加压,平衡逆向移动,降低氢气的产率,故错误;b.分离出CO,平衡正向移动,提高氢气的产率,故正确;c.加热,平衡正向移动,提高氢气的产率,故正确;d.增大碳固体的量,反应物浓度不变,平衡不移动,故错误。答案选bc;②温度相同,a点CO的体积分数大于b点,则水的转化率a点较大,正反应为吸热反应,c点温度高于a点,升高温度平衡正向移动水的转化率增大,故三点对应的水的转化率最小的是b;(3)700℃、P3时,CO的体积分数为40%, C(s)+H2O (g)
CO(g)+H2(g)为气体体积增大的吸热反应。a.加压,平衡逆向移动,降低氢气的产率,故错误;b.分离出CO,平衡正向移动,提高氢气的产率,故正确;c.加热,平衡正向移动,提高氢气的产率,故正确;d.增大碳固体的量,反应物浓度不变,平衡不移动,故错误。答案选bc;②温度相同,a点CO的体积分数大于b点,则水的转化率a点较大,正反应为吸热反应,c点温度高于a点,升高温度平衡正向移动水的转化率增大,故三点对应的水的转化率最小的是b;(3)700℃、P3时,CO的体积分数为40%, C(s)+H2O (g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
开始时的量(mol) 1 0 0
改变的量(mol) 0.12 0.12 0.12
平衡时的量(mol) 0.88 0.12 0.12
反应后容器的体积为![]() ,①10min内CO的平均反应速率为
,①10min内CO的平均反应速率为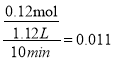 mol·L-1·min-1;②此温度下该反应的平衡常数K=
mol·L-1·min-1;②此温度下该反应的平衡常数K=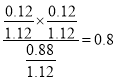 ;③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线,开始时为水的摩尔质量18g/mol,随着反应的进行气体的体积增大,平均摩尔质量减小,故图如下:
;③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线,开始时为水的摩尔质量18g/mol,随着反应的进行气体的体积增大,平均摩尔质量减小,故图如下: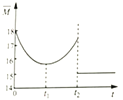 ;④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是压强增大,水蒸气液化。
;④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是压强增大,水蒸气液化。

【题目】在某一温度条件下,Bodensteins 研究了反应:2HI(g)H2(g)+I2(g),气体 混合物中 HI 的物质的量分数 x(HI)与反应时间 t 的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(1)根据上述实验结果,该反应的平衡常数 K 的计算式为 .
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=min.

