题目内容
【题目】实验题
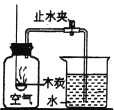
如图,在试管①中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓H2SO4充分摇匀,冷却后再加2g无水醋酸钠,用玻璃棒搅拌后将试管固定在铁架台上。在试管②中加入5mL饱和Na2CO3溶液,按图连接好装置,用酒精灯对试管①小火加热3~5min后,再改用大火加热,当观察到试管②有明显现象时停止实验。

(1)加入浓H2SO4的目除了制乙酸外,还有哪两个作用?________________、__________ ;
(2)写出试管①中主要反应的化学方程式________________________________________;
(3)试管②中观察到的现象是____________________________________________________;
(4)该实验中球形干燥管的主要作用是________________。
(5)饱和Na2CO3溶液的作用有三条,分别是:________________________________。
【答案】 作催化剂 吸水剂 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 液体分层 防止液体倒吸 降低乙酸乙酯的溶解度、吸收乙酸、溶解乙醇
CH3COOCH2CH3+H2O 液体分层 防止液体倒吸 降低乙酸乙酯的溶解度、吸收乙酸、溶解乙醇
【解析】本题考查实验方案设计与评价,(1)乙酸和乙醇发生酯化反应,反应方程式为CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O,浓硫酸作催化剂,因为此反应是可逆反应,利用浓硫酸的吸水性,促使平衡向正反应方向移动,因此浓硫酸的作用是作催化剂和吸水剂;(2)根据(1)反应方程式为CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,浓硫酸作催化剂,因为此反应是可逆反应,利用浓硫酸的吸水性,促使平衡向正反应方向移动,因此浓硫酸的作用是作催化剂和吸水剂;(2)根据(1)反应方程式为CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;(3)饱和碳酸钠的作用是吸收乙醇,吸收乙酸,降低乙酸乙酯的溶解性,使之析出,因此出现分层现象;(4)干燥管的作用是防止倒吸;(5)制备的乙酸酯中含有乙醇、乙酸杂质,乙醇易溶于水,乙酸的酸性强于碳酸,因此乙酸与碳酸钠发生反应,因此碳酸钠溶液的作用是收乙醇,吸收乙酸,降低乙酸乙酯的溶解性,使之析出。
CH3COOCH2CH3+H2O;(3)饱和碳酸钠的作用是吸收乙醇,吸收乙酸,降低乙酸乙酯的溶解性,使之析出,因此出现分层现象;(4)干燥管的作用是防止倒吸;(5)制备的乙酸酯中含有乙醇、乙酸杂质,乙醇易溶于水,乙酸的酸性强于碳酸,因此乙酸与碳酸钠发生反应,因此碳酸钠溶液的作用是收乙醇,吸收乙酸,降低乙酸乙酯的溶解性,使之析出。

【题目】
(1)室温时纯水中c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A.NaOH B.Na2SO4 C.NH4Cl
试回答如下问题:
I.溶液中H+、OH-浓度变化情况(填“变大”“减小”或“不变”)
II. c(H+)与c(OH-)大小比较(填“>”“<”或“=”)
III.溶液的酸碱性(填“酸性”“碱性”或“中性”)
请按上述要求补完整表中相关内容
A.NaOH | a Na2SO4 | C.NH4C1 | |
c(H+) | 减少 | ①________ | 增大 |
c(OH-) | ②_______ | 不变 | ③_____ |
c(H+)与c(OH-)的大小比较 | ④_______ | = | > |
溶液的酸碱性 | 碱性 | ⑤_______ | 酸性 |
(2)己知25℃合成氨反应中,1 mol N2完全转化为NH3时释放的能量为92.4 kJ。X现将1 molN2和3 mol H2混合置于2 L密闭容器中,反应进行到2 s末测得NH3为0.4mol。试回答:
①该反应的热化学方方程式为 ________________________。
②该反应达到平衡后,升髙温度平衡向_____(填“正”或“逆”)反应方向移动;增大压强平衡向_____ (填“正”或“逆”)反应方向移动;加入催化剂平衡________(填“能”或“不能”)移动。
③前2 s内v(H2)为_____________。