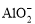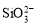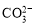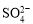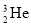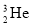题目内容
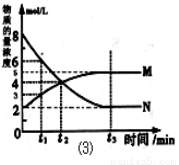
下图是可逆反应X + Y  Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )

A.t1时,正反应速率大于逆反应速率
B.t2时,达到该条件下的最大反应限度
C.t2- t3,反应不再发生,各物质的 浓度相等
浓度相等
D.t3后,该反应的反应限度有可能被外界条件改变
C
【解析】
试题分析:A.该反应是从正反应方向开始的。在t1时,正反应速率大于逆反应速率,反应正向进行。正确。B.任何反应都是在一定条件下进行的,在t2时,反应达到该条件下的最大反应限度。正确。C.化学平衡是动态平衡。在t2- t3,反应仍然在进行,反应混合物各物质的 浓度消耗速率与产生速率相等,所以浓度不再发生变化。错误。D.任何平衡都是在一定条件下的平衡,在t3后,若改变外界条件,该反应的平衡被破坏,就会建立新条件下的平衡状态。正确。
浓度消耗速率与产生速率相等,所以浓度不再发生变化。错误。D.任何平衡都是在一定条件下的平衡,在t3后,若改变外界条件,该反应的平衡被破坏,就会建立新条件下的平衡状态。正确。
考点:考查化学反应速率和化学平衡的知识。

练习册系列答案
相关题目