题目内容
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
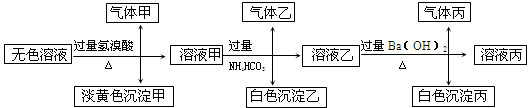
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 。

回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 。
(1)2S2- + SO32- + 6H+ =" 3S↓+" 3H2O;
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑; (3)S2-、SO32-、AlO2-、Na+、CO32-。
(4)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)
| 步骤 | 实验目的 | 试剂 |  现象 现象 |
| 1 | 检验SO2 | 品红溶液 | 红色褪去 |
| 2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
| 3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑; (3)S2-、SO32-、AlO2-、Na+、CO32-。
(4)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)
试题分析:分析题给流程图知,无色溶液与过量氢溴酸反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体甲,所以淡黄色沉淀为单质硫,是硫化氢与二氧化硫反应生成的,溶液中一定存在S2-和SO32-,一定不会存在Ag+、Ba2+、Al3+;根据电中性原则溶液中一定含有Na+,气体甲由两种氧化物组成,为二氧化碳和二氧化硫,溶液中一定有CO32-,溶液甲中含有过量的氢溴酸,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子;溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或硫酸钡,所以溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-、CO32-; 一定不存在的离子为:Ag+、Ba2+、Al3+;可能存在的离子为:SO42-,
(1)生成的淡黄色沉淀为单质硫,反应的离子方程式为:6H++2S2-+SO32-═3S↓+3H2O;气体甲由两种氧化物组成,为二氧化碳和二氧化硫,检验者两种气体的流程为:用品红溶液检验二氧化硫,用酸性高锰酸钾溶液除尽二氧化硫,用澄清石灰水检验二氧化碳;
(2)根据推断可知,溶液甲中含有铝离子,能够与碳酸氢铵中的碳酸氢根离子发生水解相互促进的反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,
(3)根据以上分析,原溶液中一定存在的离子有:Na+、S2-、SO32-、CO32-、AlO2-;
(4)考查硫酸根离子的检验,方法为:取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。

练习册系列答案
相关题目
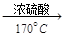 CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):
CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个): 