题目内容
硫酸是化工业的重要原料,其消耗量可作为一个国家工业发展水平的一种标志。硫酸工厂厂址的选择是一个复杂的问题,主要和以下因素有关:是否有市场需求;是否接近原料供应地;是否达到环境保护的要求;土地供应是否充足;交通运输是否方便;能源是否充足且价廉;水源是否充足。又已知硫酸是一种腐蚀性液体,不便多储存,需随产随销。另外,硫酸的运输价格比较贵,据计算1吨硫酸的运价约为同质量的黄铁矿石的3倍。(注:H2SO4的制取以黄铁矿为原料,流程为:黄铁矿→SO2→SO3→H2SO4)
据以上信息,分析下列条件:
条件Ⅰ:
①A城市郊区有丰富的黄铁矿,水源、能源充足,交通方便。
②A城市需使用硫酸的工业不多,而离它较远的B城市却是一个消耗硫酸甚多的工业城市。
③A城市是一个风光秀丽的旅游城市,对环境保护的要求很高,而且土地价格较贵,土地供应紧张。
条件Ⅱ:
①C城市是重要农业区,需消耗大量的肥料。
②C城市有丰富的磷灰石矿藏,水源、能源充足,土地价格较低,土地供应充足,交通方便。
③磷肥是由磷灰石〔有效成分是Ca3(PO4)2〕与H2SO4作用制得的,制造磷肥需消耗大量的硫酸。
④C城市无磷肥厂和硫酸厂,在相邻的D城市有丰富的黄铁矿资源。
(1)在A、B、C、D四城市中,你认为应该建设硫酸工厂的城市是__________,应该建造磷肥厂的是__________。(填城市的代号)
(2)在建造的硫酸工厂,每天排放1×104 m3(标准状况下)的尾气中含0.2%(体积分数)的SO2。若用NaOH溶液、石灰及氧气处理,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(3)如果将一定体积的尾气通入100 mL 2 mol·L-1 NaOH溶液使其完全反应,经测定所得溶液含16.7 g 溶质。试分析该溶质的成分,通过计算确定溶质成分的物质的量。
(1)BC C
(2)155.4 kg
(3)既有Na2SO3,又有NaHSO3
n(Na2SO3)=0.05 mol
n(NaHSO3)=0.1 mol
解析:(2)依据硫元素守恒,
SO2 — CaSO4·2H2O
22.4 L 172 g
1×104×103×0.2% L x
解得x=1×104×103×0.2% L×172 g÷22.4 L=155.4×103 g=155.4 kg
(3)n(NaOH)=0.1 L×2 mol·L-1=0.2 mol
若全部生成Na2SO3,则溶液中溶质m(Na2SO3)=![]() ×0.2 mol×126 g·mol-1=12.6 g
×0.2 mol×126 g·mol-1=12.6 g
若全部生成NaHSO3,则溶液中溶质m(NaHSO3)=0.2 mol×104 g·mol-1=20.8 g。而溶液中实含溶质16.7 g,大于12.6 g,小于20.8 g。因此既有Na2SO3,又有NaHSO3。
设其中含x mol Na2SO3,y mol NaHSO3,则
![]()
解之得x=0.05,y=0.1
所以n(Na2CO3)=0.05 mol,
n(NaHSO3)=0.1 mol。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
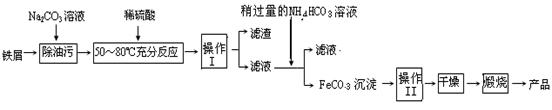
①操作I的名称是_______,操作II的名称是________;操作Ⅱ的方法为_____________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)____________________;
③请完成生成FeCO3沉淀的离子方程式__________________
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+ = 5Fe3++Mn2+ +4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________________。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是_________
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
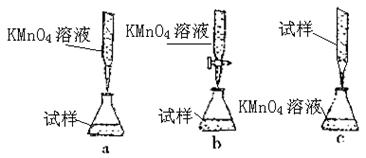
③某同学设计的下列滴定方式,最合理的是_______。 (夹持部分略去)(填字母序号)