题目内容
7.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察图1,然后回答问题:(1)图中所示反应是放热(填“吸热”或“放热”)反应,该反应的△H=E2-E1 (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能为409.0KJ/mol.
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是最有可能使用了催化剂.
(4)已知TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1.
(5)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出724 kJ能量.
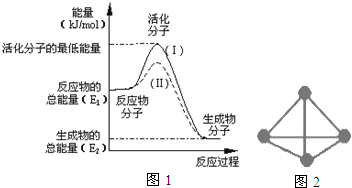
分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响所以速率的元素分析判断;
(4)已知TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
根据盖斯定律计算分析得到;
(5)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能计算.
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;△H=E2-E1;故答案为:放热;E2-E1 ;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂;故答案为:最有可能使用了催化剂;
(4)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
(5)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJ•mol-1-2×941 kJ•mol-1=-724 kJ•mol-1,
故答案为:724.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算以及盖斯定律的应用,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题关键.

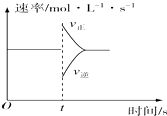 在一定条件下,向某一密闭容器中,加入一定量的HI或加入一定量的PCl5,反应达到平衡后,在t时刻改变条件,其反应速率与时间的变化关系均可用图表示.那么对于不同反应在t时刻改变条件的叙述正确的是( )
在一定条件下,向某一密闭容器中,加入一定量的HI或加入一定量的PCl5,反应达到平衡后,在t时刻改变条件,其反应速率与时间的变化关系均可用图表示.那么对于不同反应在t时刻改变条件的叙述正确的是( )| A. | 对于2HI(g)?I2(g)+H2(g)反应,t时刻保持温度和体积不变,再加入一定量的HI | |
| B. | 对于2HI(g)?I2(g)+H2(g)反应,t时刻保持温度和压强不变,再加入一定量的HI | |
| C. | 对于PCl5(g)?PCl3(g)+Cl2(g)反应,t时刻保持温度和体积不变,再加入一定量的PCl5 | |
| D. | 对于PCl5 (g)?PCl3(g)+Cl2(g)反应,t时刻保持温度和压强不变,再加入一定量的PCl3 |
| A. | BaSO4=Ba2++SO42- | B. | NaHSO4=Na++HSO4- | ||
| C. | H2SO4=2H++SO42- | D. | NaHCO3=Na++HCO3- |
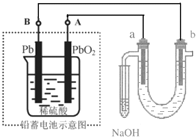 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时的正极反应是:PbO2+4H++SO42-═PbSO4+2H2O | |
| B. | 电解苦卤水时,a 电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- | |
| C. | 铅蓄电池充电时,A极应与外接电源负极相连 | |
| D. | 忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4 |
| A. | 由不同原子构成的纯净物一定是化合物 | |
| B. | 非金属氧化物一定是酸性氧化物 | |
| C. | 含金属元素的离子一定都是阳离子 | |
| D. | 胆矾是纯净物,水泥是混合物 |