题目内容
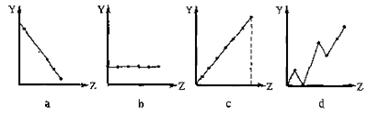
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。
(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离 ,B能促
,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目 为 ▲ 。
为 ▲ 。
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。

(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离
 ,B能促
,B能促 进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目
 为 ▲ 。
为 ▲ 。(13分)(1)b, c,a(各1分)
(2)①SO2 SO3(各1分) ②NaOH NaClO(各1分)
③Na2O2电子式略(2分) ④H2O2+H2S=S+2H2O (2分) 2e-(2分)
(2)①SO2 SO3(各1分) ②NaOH NaClO(各1分)
③Na2O2电子式略(2分) ④H2O2+H2S=S+2H2O (2分) 2e-(2分)
略

练习册系列答案
相关题目
 结构
结构 (4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式 ▲ 。
(4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式 ▲ 。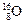 、
、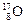 、
、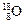 三种核素,氢元素有
三种核素,氢元素有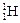 、
、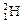 、
、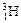 三种核素。
三种核素。 中子数为 mol,电子数为 个。
中子数为 mol,电子数为 个。
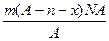
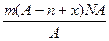
 周期元素,它们的原子结构或性质如下表所示:
周期元素,它们的原子结构或性质如下表所示:
 子式为 .
子式为 .