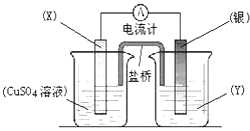
��Ŀ����
����Ŀ����ҵ���ɻ�ͭ����Ҫ�ɷ� CuFeS2����ȡ FeSO4��7H2O ��Cu����Ҫ�������£�

��1��������������� Fe2+�Ƿ�������Ӧѡ��________������ĸ��ţ���
A��KMnO4 ��Һ B��K3[Fe(CN)6]��Һ C��KSCN ��Һ
��2�������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��
��3��ijͬѧ��ʢ�� H2O2 ��Һ���Թ��м��뼸���ữ�� FeSO4 ��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ___________��һ��ʱ�����Һ�������ݳ��֣������ȣ�����к��ɫ�������ɣ��������ݵ�ԭ����_________�����ɳ�����ԭ����___________����ƽ���ƶ�ԭ�����ͣ���
��4����֪ 25��ʱ�� Ksp[Fe(OH)3]=4.0��10��38�� ���¶��£���ʵ���������� 2.5mol/L 100 mLFe2(SO4)3 ��Һ��Ϊʹ���ƹ����в����ֻ��ǣ���������Ҫ��10mol/L������______mL�����Լ���������������
���𰸡� C CuFeS2��H2SO4 = CuS��FeSO4��H2S�� H2O2��2Fe2+��2H+=2Fe3+��2H2O Fe3+�� H2O2 �ֽ���� O2 H2O2 �ֽⷴӦ���ȣ� �ٽ� Fe3+��ˮ��ƽ�������ƶ� 0.25
����������1������������� Fe2+������������Һ�к���Fe3+������Fe3+Ӧѡ��KSCN ��Һ������Һ�е���KSCN ��Һʱ����Һ��ΪѪ��ɫ��֤����������� Fe2+�ѱ�����������û����������ѡC����2����������л�ͭ�������ᷴӦ������ͭ�������������������壬��Ҫ��Ӧ�Ļ�ѧ����ʽΪCuFeS2��H2SO4 = CuS��FeSO4��H2S������3������������H2O2 �� FeSO4 ��������Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪH2O2��2Fe2+��2H+=2Fe3+��2H2O��һ��ʱ�����Һ�������ݳ��֣������ȣ�����к��ɫ�������ɣ��������ݵ�ԭ����Fe3+�� H2O2 �ֽ���� O2�����ɳ�����ԭ����H2O2 �ֽⷴӦ���ȣ� �ٽ� Fe3+��ˮ��ƽ�������ƶ�����4���������ֻ���������c��Fe3+����C3��OH-����Ksp[Fe��OH��3]��c��Fe3+��=2��2.5mol/L=5.0 mol/L�������й����ݺ�����c��OH-����2��10-13mol/L��c��H+����0.05mol/L�������������������Ϊ![]() =0.00025L=0.25mL��
=0.00025L=0.25mL��

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д�