题目内容
2.下列有关说法正确的是( )| A. | H2、SO2、CO2三种还原性气体都可用浓硫酸干燥 | |
| B. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 向Na2O2与水完全反应后的溶液中加MnO2,产生O2,是由于该溶液中含H2O2 |
分析 A、H2和SO2具有还原性,而二氧化碳无还原性;
B、二氧化硫能使溴水褪色,是氧化还原反应而褪色;
C、焰色反应为元素的性质,钠的焰色反应为黄色,而K的焰色反应需要通过蓝色的钴玻璃观察;
D、二氧化锰对过氧化氢分解起催化作用.
解答 解:A、H2和SO2具有还原性,而二氧化碳中的碳元素是+4价最高价无还原性,故A错误;
B、二氧化硫能使溴水褪色,是氧化还原反应而褪色,二氧化硫具有还原性,故B错误;
C、用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,没有通过蓝色的钴玻璃观察,则可能有K+,故C错误;
D、二氧化锰对过氧化氢分解起催化作用,液中加MnO2,产生O2,是由于该溶液中含H2O2,故D正确;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、焰色反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
12.下列实验方案正确且能达到相应实验预期目的是( )
| A. | 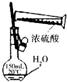 配制一定物质的量浓度的硫酸溶液 配制一定物质的量浓度的硫酸溶液 | B. | 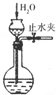 检验装置的气密性 检验装置的气密性 | ||
| C. | 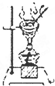 从碘水中分离碘单质 从碘水中分离碘单质 | D. | 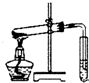 探究碳酸氢钠的热稳定性 探究碳酸氢钠的热稳定性 |
13.对于:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol的叙述错误的是( )
| A. | 该反应的反应热为△H=-571.6kJ/mol,是放热反应 | |
| B. | 该反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ | |
| D. | 该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol |
10.2015 年我国发布《食品安全国家标准--包装饮用水》,除了天然矿泉水外,包装饮用水将只分为两种类别:饮用纯净水和其他饮用水.下列关于水在人体中的作用叙述错误的是( )
| A. | 调节体温 | B. | 帮助消化 | C. | 排泄废物 | D. | 提供能量 |
17.沸腾时只需克服范德华力的物质是( )
| A. | 水 | B. | CCl4 | C. | 氨水 | D. | 水银 |
7.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电解过程中溶液pH不会变化 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
14.X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
(1)W位于元素周期表第四周期第Ⅷ族,其基态原子最外层有2个电子.
(2)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目: .
.
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称:丙烷.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:CH3COOH+HCO3-=CH3COO-+H2O+CO2↑.
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| A | Z存在质量数为23,中字数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
 .
.(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称:丙烷.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:CH3COOH+HCO3-=CH3COO-+H2O+CO2↑.
 .
.