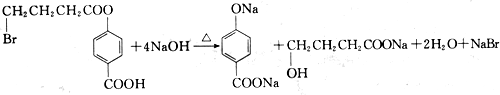
题目内容
(2008?闵行区模拟)下列各项中的两个量,其比值一定为1:2的是( )
分析:A、依据过氧化钠的结构分析判断;
B、依据醋酸是弱电解质溶液中存在电离平衡,浓度不同电离程度不同;
C、滴定管是精确量具,液面在0刻度,但最大刻度下的管内还有液体,50mL滴定管比25mL滴定管中的液体一定多;
D、依据氧化还原反应的特征分析计算.
B、依据醋酸是弱电解质溶液中存在电离平衡,浓度不同电离程度不同;
C、滴定管是精确量具,液面在0刻度,但最大刻度下的管内还有液体,50mL滴定管比25mL滴定管中的液体一定多;
D、依据氧化还原反应的特征分析计算.
解答:解:A、固体Na2O2中阴离子O2-与阳离子Na+的个数1:2,故A正确;
B、相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中,醋酸的电离程度不同,所以的c(H+)之比不是1:2.故B错误;
C、25mL滴定管和50mL滴定管的管径不同,滴定管刻度线下没有刻度,但充满液体,所以体积不是1:2,故C错误;
D、反应2H2S+SO2→3S↓+2H2O中氧化产物S与还原产物S的质量比为2:1,故D错误;
故选A.
B、相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中,醋酸的电离程度不同,所以的c(H+)之比不是1:2.故B错误;
C、25mL滴定管和50mL滴定管的管径不同,滴定管刻度线下没有刻度,但充满液体,所以体积不是1:2,故C错误;
D、反应2H2S+SO2→3S↓+2H2O中氧化产物S与还原产物S的质量比为2:1,故D错误;
故选A.
点评:本题考查了物质的结构,弱电解质的定量平衡,滴定管的结构和使用,氧化还原反应的应用.

练习册系列答案
相关题目

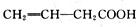
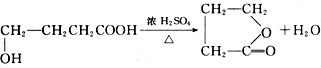
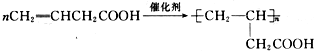 ;
;