题目内容
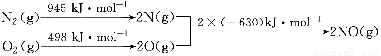
(1)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
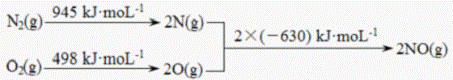
写出该反应的热化学方程式:______ ks5u
(2)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)= H2O(l) △H=-44kJ/mol,ks5u
写出CO与水蒸气反应生成 CO2和H2的热化学方程式______
(3)某温度下在容积固定的密闭容器中,反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡,起始所放反应物的物质的量之比与其转化率如下表:
CO2(g)+H2(g)达到平衡,起始所放反应物的物质的量之比与其转化率如下表:
| n(CO):n(H2O) | CO转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为______ 。该温度下,向容器中充入1molCO、3mol H2O、2mol CO2、1.5molH2,则起始时该反应速率V正_____ V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是______ _
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的之比为1:4时,M的转化率为0.85
(1)N2(g)+O2(g)=2NO(g) △H=+183KJ/mol;
(2) CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=―41.2kJ/mol
CO2(g)+H2(g) △H=―41.2kJ/mol
(3) ① 1 = ② AB ks5u

练习册系列答案
相关题目