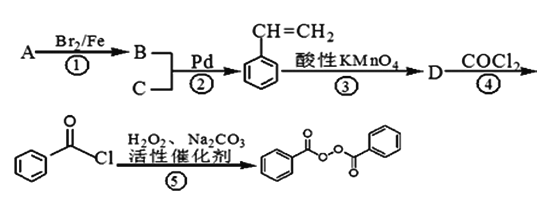
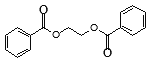
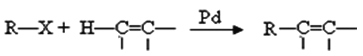题目内容
【题目】按要求完成下列填空:
(1)![]() H、
H、 ![]() H、
H、 ![]() H互为 , 16O2、18O3互为 . A.同位素 B.相同物质
H互为 , 16O2、18O3互为 . A.同位素 B.相同物质
C.同素异形体 D.同分异构体
(2)写出下列物质的电子式: ①MgCl2; ②NaOH;
(3)写出下列物质的结构式: ①C2H2; ②H2O;
(4)已知拆开1mol H﹣H键、1mol N﹣H键、1mol N≡N键分别需要的能量是436KJ、391KJ、946KJ,则N2与H2反应生成NH3的热化学方程式为 .
【答案】
(1)A;C
(2)![]() ;
;![]()
(3)H﹣C≡C﹣H;H﹣O﹣H
(4)N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ/mol
【解析】解:(1) ![]() H、
H、 ![]() H、
H、 ![]() H的质子数均为1,中子数不同,互为同位素;16O2、18O3为O元素的不同单质,二者互为同素异形体,所以答案是:A;C;(2)氯化镁为只含离子键的离子化合物,NaOH含离子键和共价键,电子式分别为
H的质子数均为1,中子数不同,互为同位素;16O2、18O3为O元素的不同单质,二者互为同素异形体,所以答案是:A;C;(2)氯化镁为只含离子键的离子化合物,NaOH含离子键和共价键,电子式分别为 ![]() 、
、 ![]() , 所以答案是:
, 所以答案是: ![]() ;
; ![]() ;(3)乙炔含碳碳三键、C﹣H键,水中只含O﹣H键,结构式分别为H﹣C≡C﹣H、H﹣O﹣H,
;(3)乙炔含碳碳三键、C﹣H键,水中只含O﹣H键,结构式分别为H﹣C≡C﹣H、H﹣O﹣H,
所以答案是:H﹣C≡C﹣H;H﹣O﹣H;(4)焓变等于断裂化学键吸收的能量减去成键释放的能量,△H=(946KJ/mol)+(436KJ)×3﹣(391KJ/mol)×6=﹣92kJ/mol,结合物质的状态、焓变可知热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ/mol,
所以答案是:N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ/mol.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目