题目内容
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
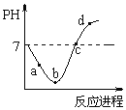
A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
【答案】C
【解析】
据题意,过程分为两个阶段:先向纯水中通入氯气至饱和,再向氯水中滴加NaOH溶液至过量。注意氯气与水的反应可逆,生成的次氯酸为弱酸,次氯酸钠能水解。
A项:曲线起点pH=7为纯水,通入氯气后经a点至b点达到饱和,此过程发生的反应为Cl2+H2O![]() HCl+HClO,A项错误;
HCl+HClO,A项错误;
B项:b点所示溶液为饱和氯水,其中存在Cl2+H2O![]() HCl+HClO,HCl=H++Cl-,HClO
HCl+HClO,HCl=H++Cl-,HClO![]() H++ClO-,故存在Cl2、H2O、HClO三种分子,B项错误;
H++ClO-,故存在Cl2、H2O、HClO三种分子,B项错误;
C项:a、b溶液为氯水,其中H+抑制水电离。b点之后向饱和氯水中滴加NaOH溶液,c点时pH=7,溶质为NaCl、NaClO和少量HClO,水的电离程度较大。d点溶液碱性较强,过量的OH-抑制水电离。故c点溶液中水的电离程度最大,C项正确。
D项:d点溶液中,溶质为NaCl、NaClO和NaOH,故钠离子的物质的量大于氯原子的物质的量,D项错误。
本题选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目