题目内容
【题目】根据题意填空
(1)有一学生在实验室测某溶液pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
①这种错误操作(填“一定”/“一定不”/“不一定”)会导致实验结果有误差.
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 .
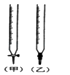
(2)用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考如图,从表中选出正确序号
序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |
|
A | 碱 | 酸 | 石芯 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
【答案】
(1)不一定;盐酸
(2)D
(3)ADE
【解析】解:(1)①中性溶液用水稀释后pH不变;酸性溶液稀释后,溶液酸性减弱,pH变大;碱性溶液稀释后,碱性变小,pH值将变小,所以测定的结果不一定有误差,若是中性溶液则不变;
所以答案是:不一定;②用水润湿相当于稀释,则所测的PH偏大,由于稀释会促进弱电解质的电离,稀释过程中醋酸继续电离出氢离子,使得溶液中氢离子浓度变化比盐酸的小,故盐酸的PH误差大,所以答案是:盐酸;(2)已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,锥形瓶中为酸,滴定管中盛放NaOH溶液,图中滴定管选择乙,选择酚酞为指示剂,所以答案是:D;(3)A.配制标准溶液的氢氧化钠中混有Na2CO3杂质,导致所用氢氧化钠溶液体积偏大,由c酸= ![]() 可知,测定酸浓度偏高,故A选;
可知,测定酸浓度偏高,故A选;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,其读数偏小,V(NaOH)偏小,由c酸= ![]() 可知,测定酸浓度偏小,故B不选;
可知,测定酸浓度偏小,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,酸的物质的量不变,实验无影响,故C不选;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,V(NaOH)偏高,由c酸= ![]() 可知,测定酸浓度偏高,故D选;
可知,测定酸浓度偏高,故D选;
E.未用标准液润洗碱式滴定管,氢氧化钠浓度降低,导致所用氢氧化钠体积增多,由c酸= ![]() 可知,测定酸浓度偏高,故E选;
可知,测定酸浓度偏高,故E选;
所以答案是:ADE.
【考点精析】本题主要考查了酸碱中和滴定的相关知识点,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能正确解答此题.