题目内容
一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:
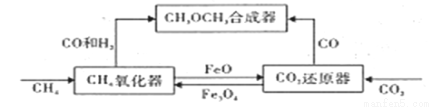
(1)二甲醚的合成反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s) CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s) CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如右下图。
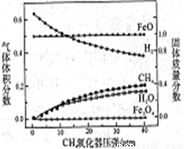
①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s) Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案下列实验操作不能达到实验目的的是
实验目的 | 实验操作 | |
A | 除去蛋白质溶液中混有的(NH4)2SO4 | 将混合物装入半透膜袋,并放入流动的蒸馏水中 |
B | 除去Mg粉中混有的A1粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
D. | 测定NaClO溶液的pH | 用玻璃棒蘸取溶液点滴在pH上,与标准比色卡对照 |
A.A B.B C.C D.D
25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+) ___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。

(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)



 CH3OH(l) △H=?
CH3OH(l) △H=?

