题目内容
氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。

⑴请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的 键比 键稳定(填“ ”“
”“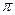 ”)。
”)。
⑶Li3N晶体中氮以N3-存在,基态N3-的电子排布式为
⑷2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(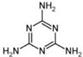 )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
⑸继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。

⑴请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的 键比 键稳定(填“
 ”“
”“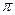 ”)。
”)。⑶Li3N晶体中氮以N3-存在,基态N3-的电子排布式为

⑷2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(
 )。
)。下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
⑸继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。
⑴2N(s)=N2(g) △H= -462kJ/mol
(2)

⑶1s22s22p6
⑷B
⑸N>C>Si >K
(2)

⑶1s22s22p6
⑷B
⑸N>C>Si >K
略

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,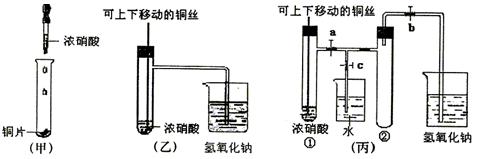


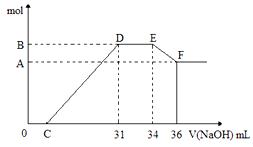
 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。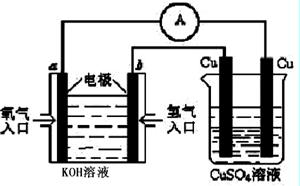
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol