题目内容
下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是
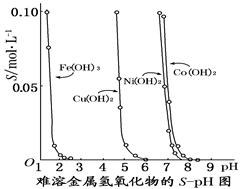
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
【答案】
C
【解析】
试题分析:根据图像可知,pH=3时溶液中铁元素的主要存在形式是氢氧化铁,A不正确;根据图像可知,氢氧化钴完全沉淀时的pH大于氢氧化镍完全沉淀时的pH,所以当Co2+完全沉淀时Ni2+也已经完全沉淀,B不正确;pH=4时,铁离子完全转化为氢氧化铁沉淀,而铜离子还留在溶液中,C正确;D不正确,因为铜离子完全沉淀时的pH小于氢氧化镍完全沉淀时的pH,答案选C。
考点:考查溶度积常数的有关计算、判断和应用
点评:该题是高考中的常见图像,难度较大,试题综合性强。本题用图表表述化学过程或呈现背景信息是化学常用的表达方式。图表往往拥有较大的信息存储量,能够很全面地考查学生分析、比较、概括、归纳问题的能力。

练习册系列答案
相关题目
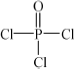 )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.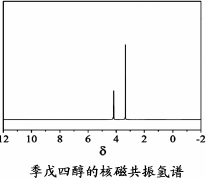
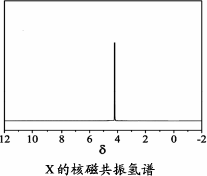

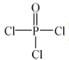 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。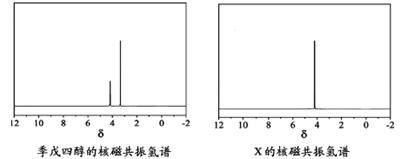
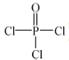 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。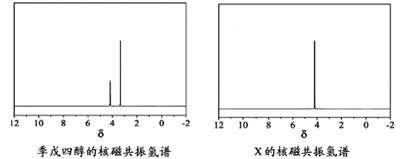
 60molCuSO4能氧化白磷的物质的量是 。
60molCuSO4能氧化白磷的物质的量是 。 )与季戊四醇(
)与季戊四醇(