题目内容
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池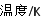 (如图),试分析:
(如图),试分析:
①闭合K,写出左池X电极的反应式__________________________________;
②闭合K,当X电极消耗1.6g化合物戊时(假设过程中无任何损失),则右池两极共放出气体在标准状况下的体积为_________升。
(1)第三周期第ⅥA族(对一个计1分)
(2)离子键 、共价键(对一个计1分)?? c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(3)N2H4 + 2H2O2 =N2↑+ 4H2O
(4)NaHSO3 (1分)?? HSO3-的电离程度比其水解程度强(合理答案均计分)
(5)①?? CH4+10OH--8e-=CO32-+7H2O (写HCO3 - 且方程式正确也计分)?????? ② 4.48
【解析】
试题分析:A、B、C、D是组成蛋白质的基本元素,则应为C、H、O、N,又A与B的原子序数之和等于C原子核内的质子数,所以A、B分别为H、C元素,C为N元素,D为O元素,A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍,短周期内E为Na元素,F为S元素,(1)S在元素周期表中的位置是第三周期第ⅥA族;
(2)由H、N、O、S按8:2:4:1原子个数比组成的化合物甲的化学式是(NH4)2SO4,含有共价键和离子键两种化学键;
(3)由N、H元素构成的化合物乙的相对分子质量为32,利用“商余法”可计算乙的分子式为N2H4,电子总数是18,则由H、O构成的化合物丙的分子式为H2O2,N2H4与H2O2反应的化学方程式为N2H4 + 2H2O2 =N2↑+ 4H2O;
(4)由H、O、Na、S构成的化合物丁能与硫酸反应并放出刺激性气味的气体是二氧化硫,所以丁的分子式 为NaHSO3,丁溶液显弱酸性,说明HSO3-的电离程度大于它的水解程度;
(5)①C、H原子个数比为1:4的化合物戊的分子式为CH4,左池为原电池,X极是负极发生氧化反应,结合电解质溶液,其电极方程式是CH4+10OH--8e-=CO32-+7H2O (写HCO3 - 且方程式正确也计分),②当X电极消耗1.6g CH4时,共转移0.8mol电子,在右池中只有石墨极有气体氧气放出,2 OH--4e-=O2↑+2 H+,所以产生的氧气的物质的量为0.2mol,在标准状况下的体积是4.48L。
考点:考查元素推断、化学键的类型、化学式的判断、化学方程式的书写、盐溶液中水解、电离的判断、原电池、电解池的反应原理及应用

| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

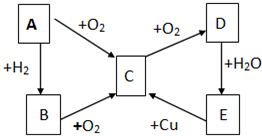 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: