题目内容
13.l~36号的四种元素A、B、C、D,其原子序数依次增大且属于不同周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:
(l)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
 .
.(2)C所在主族的前四种元索分别与A形成的化合物,沸点由高到低的顺序是HF>HI>HBr>HCl(填化学式),呈现如此递变规律的原因是HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高.
(3)D元素的基态电子排布式为1s22s22p63s23p63d104s1
(4)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是:首先生成蓝色沉淀.继续加氨水,沉淀溶解,得到深蓝色透明溶液.请写出上述过程的离子方程式(两个离子方程式);Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
分析 l~36号的四种元素A、B、C、D,其原子序数依次增大且属于不同周期,自然界中存在多种A的化合物,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为Cu元素,结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为Cl元素,据此进行解答.
解答 解:l~36号的四种元素A、B、C、D,其原子序数依次增大且属于不同周期,自然界中存在多种A的化合物,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为Cu元素,结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为Cl元素,
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,其基态原子的价电子排布图为 ,
,
故答案为: ;
;
(2)HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高,即沸点由高到低的顺序是HF>HI>HBr>HCl,
故答案为:HF>HI>HBr>HCl;HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高;
(3)Cu为29号元素,原子核外有29个电子,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(5)硫酸铜溶液中加入氨水会产生蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,得到四氨合铜络离子,沉淀溶解离子方程式为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
点评 本题考查位置结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8(mol•L-1)3;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.

 .
.


 ;
;
 .
. .
. +
+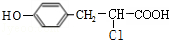 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.