题目内容
【题目】国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。下列说法不正确的是( )
A.钠米金属燃料,更易点燃
B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离
C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果
D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量
【答案】D
【解析】
A. 钠米金属燃料比表面积大,活性高,易点燃,A项正确;
B. 铁燃烧的产物Fe3O4具有磁性,B项正确;
C.可以利用镁在二氧化碳中燃烧,放出热量的同时收集碳单质,C项正确;
D. 分解反应一般都是吸热反应,D项不正确;
答案选D。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。
甲. ![]()
乙. ![]()
(1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________ (用化学方程式表示)。
(2)乙同学方案中NaOH固体的作用为_____________________________________________。
(3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母);
②装置B的作用为___________,装置D的作用为__________________________。
Ⅱ.定性分析产物
操作步明 | 实验现象 | 解释原因 |
取少量产品于试管中,加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | (4)反应的化学方程式为___________ |
. | ||
弃去上层淸液,加入足量稀盐酸 | 观察到固体全部溶解,且有气泡冒出 | (5)气泡冒出的原因为_____________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。
(6)产物中氮化镁的质量分数为_______________。
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
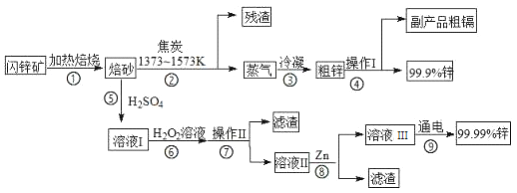
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点 (K) | 693 | 1812 | 1356 | 594 |
沸点 (K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
Fe3+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀pH | l.l | 5.9 | 4.7 | 6.9 |
完全沉淀pH | 3.2 | 8.9 | 6.7 | 9.6 /span> |
请回答下列问题:
(1) 步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程式___________________________________________________。
(2)步骤④中操作I的分离方法为蒸馏,得到副产品粗镉需控制温度为____左右。
(3)步骤⑦需调节溶液pH为_______,目的是_____________________________。
(4)写出步骤⑧中反应的离子方程式___________________________(任写一个)
(5)步骤⑨以Pt为电极进行电解,阴极的电极反应方程式为________________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为___________。