题目内容
9.某溶液可能含Cl-、CO32-、SO42-、SiO32-、Cu2+、Ba2+和Na+.探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:加入过量NaOH溶液,得到29.4g蓝色沉淀;过滤,向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀.则下列说法正确的是( )| A. | 溶液中肯定有SO42-、Cu2+;一定没有Ba2+;其余离子不能确定 | |
| B. | 溶液中肯定有SO42-、Cu2+;可能有Na+、Cl- | |
| C. | 溶液中肯定有SO42-、Cu2+、Cl-;可能有Na+ | |
| D. | 溶液中如果同时有Na+和Cl-;则C(Na+)>C(Cl-) |
分析 加入过量NaOH溶液,得到29.4g蓝色沉淀,可知一定存在铜离子,物质的量是$\frac{29.4g}{98g/mol}$=0.3mol,一定不含CO32-、SiO32-,蓝色沉淀是氢氧化铜,上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀,该沉淀是硫酸钡,一定存在硫酸根离子,物质的量是$\frac{46.6g}{233g/mol}$=0.2mol,不含钡离子,
根据以上数据推算存在离子,根据电荷守恒推算氯离子、钠离子的存在及数据.
解答 解:加入过量NaOH溶液,得到29.4g蓝色沉淀,可知一定存在铜离子,物质的量是$\frac{29.4g}{98g/mol}$=0.3mol,一定不含CO32-、SiO32-,蓝色沉淀是氢氧化铜,上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀,该沉淀是硫酸钡,一定存在硫酸根离子,硫酸根物质的量是$\frac{46.6g}{233g/mol}$=0.2mol,不含钡离子,根据电荷守恒,阳离子所带正电荷物质的量:0.3mol×2=0.6mol,阴离子所带负电荷物质的量:0.2mol×2=0.4mol,所以含有氯离子,钠离子可能存在,
A、溶液中肯定有SO42-、Cu2+、Cl-;一定没有Ba2+、SiO32-,其余离子不能确定,故A错误;
B、溶液中肯定有SO42-、Cu2+、Cl-;一定没有Ba2+、SiO32-,其余离子不能确定,故B错误;
C、溶液中肯定有SO42-、Cu2+、Cl-;可能有Na+,故C正确;
D、溶液中肯定有SO42-、Cu2+、Cl-,可能有Na+,根据电荷守恒,溶液中如果同时有Na+和Cl-,且C(Na+)<C(Cl-),放D错误.
故选C.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,题目难度中等,试题侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | Na2S 溶液:c( Na+ )>c(HS- )>c( OH- )>c(H2S) | |
| B. | Na2C2O4 溶液:c ( OH- )=c ( H+ )+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa 和 CaCl2 混合溶液:c(Na+ )+c(Ca 2+ )═c(CH3COO- )+c(CH3COOH)+2c(Cl- ) |
| A. | 单质$\stackrel{+O_{2}}{→}$ 氧化物 $\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐,能按照上述转化关系直接转化的可以是硫元素 | |
| B. | 某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| C. | 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- |
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 单质的熔点:Li<Na<K<Rb | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
 =O+RMgX→
=O+RMgX→ $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$ 现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
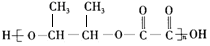 .
. 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的纸对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的纸对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).