题目内容
12.对于工业合成氨反应:N2+3H2?2NH3,下列说法不正确的是( )| A. | 增大压强可以加快反应速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 合成氨反应的限度可以随着条件的改变而改变 |
分析 A、压强增大可以加快化学反应速率;
B、升高温度可以增大反应速率;
C、反应是可逆反应,不能进行彻底;
D、在一定条件下的可逆反应经过一定的时间后,正、逆反应速率相等,反应物和生成物的浓度不再发生变化,这种表面上静止的“平衡状态”就是这个可逆反应所能达到的限度,条件改变,化学反应平衡状态被破坏,当正逆反应速率相等时,可逆反应再次达到平衡状态.
解答 解:A、增大压强相当于减小体积,单位体积活化分子的数目增大,反应速率也增大,故A正确;
B、升高温度可提高活化分子的百分数,提高反应速率,故B正确;
C、该反应为可逆反应,反应物不可能完全转化,故C错误;
D、改变影响化学平衡的条件,化学平衡被破坏,平衡移动,即改变化学反应的限度,故D正确;
故选C.
点评 本题考查学生影响化学反应速率的因素:温度、浓度、压强、催化剂,注意知识的梳理和归纳是前提,难度不大.

练习册系列答案
相关题目
3.下列物质能促进水的电离的是( )
| A. | CH3COONa | B. | Ba(OH)2 | C. | H2SO4 | D. | KNO3 |
20.下列各组离子在水溶液中一定能大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | Na+、Fe3+、NO3-、SCN- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | Fe2+、H+、NO3-、Cl- |
7.物质的量相等的A、B两种气体,下列说法中错误的是( )
| A. | 分子数目一定相等 | B. | 体积一定相等 | ||
| C. | 质量不一定相等 | D. | 分子中的原子数目可能相等 |
1.下列有机物中,与Br2反应最容易的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙酸 | D. | 苯 |
2.下列化学用语使用正确的是( )
| A. | 氢氧化钠的电子式: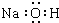 | B. | 甲烷的比例模型: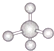 | ||
| C. | 只含有一个中子的氦原子:${\;}_{2}^{3}$He | D. | 乙醇的结构式:C2H5OH |
 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题: .
.