题目内容
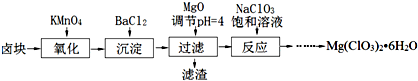
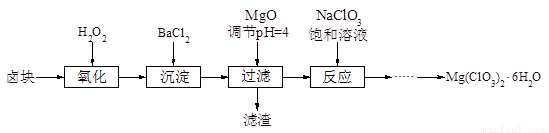
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
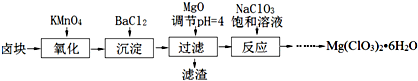
已知:①卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.
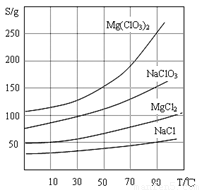
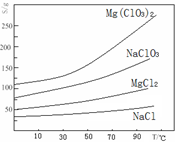
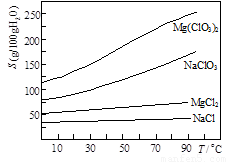
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示.

(1)过滤所需要的主要玻璃仪器有______,加MgO后过滤所得滤渣的主要成分为______.
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:______.
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2?6H2O的实验步骤依次
为:①______;②______;③______;④过滤、洗涤.
(4)产品中Mg(ClO3)2?6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol?L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol?L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
①写出步骤2中发生反应的离子方程式:______
②产品中Mg(ClO3)2?6H2O的质量分数为______.
解:(1))过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;故答案为:蒸发结晶;趁热过滤;冷却结晶;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:
ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol?L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol?L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol?L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为: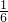 ×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:( ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ×100%=78.3%.
×100%=78.3%.
故答案为:78.3%.
分析:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,根据加氧化镁后溶液的pH为4,可以沉淀的离子来回答;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来回答;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各个质物之间的关系式,计算百分含量.
点评:本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;故答案为:蒸发结晶;趁热过滤;冷却结晶;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:
ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol?L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol?L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol?L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:
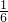 ×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:( ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ×100%=78.3%.
×100%=78.3%.故答案为:78.3%.
分析:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,根据加氧化镁后溶液的pH为4,可以沉淀的离子来回答;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来回答;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各个质物之间的关系式,计算百分含量.
点评:本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.

练习册系列答案
相关题目

 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,