题目内容
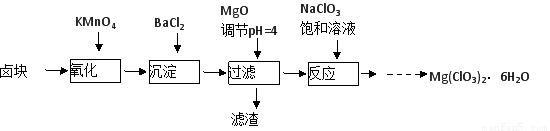
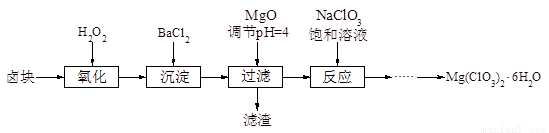
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
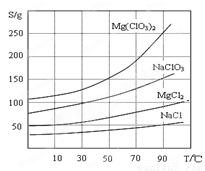
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
(1)漏斗、玻璃棒、烧杯 (2)除去SO42- BaSO4和Fe(OH)3
(3)MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓ 趁热过滤 冷却结晶
(4)①ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O ②78.3%
【解析】
试题分析:(1)过滤所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯;(2)加入BaCl2的目的是使杂质SO42-转化为沉淀除去。加MgO调整溶液的PH到4,这时Fe3+会形成Fe(OH)3沉淀.连同加入BaCl2后产生的硫酸钡沉淀一起过滤出去。所以过滤所得滤渣的主要成分为BaSO4和Fe(OH)3。(3)加入NaClO3饱和溶液后发生反应的化学方程式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓。从Mg(ClO3)2的溶液中得到Mg(ClO3)2·6H2O可利用其溶解度较大受温度的影响变化较大的特点先蒸发结晶;再趁热过滤;最后冷却结晶得到。(4)利用氧化还原反应中氧化剂得到的电子与还原剂失去的电子数相等来进行计算。①写出步骤2中发生反应的离子方程式:ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O。②在10.00 mL 溶液中1×0.02=3×2×0.015×0.1+ 6×n(ClO3- ).解得n(ClO3- )=( 0.011/6)mol.所以3.50 g产品中含有的Mg(ClO3)2·6H2O质量为{( 0.011/6)mol÷2}×10×299g/mol=2.741g.所以产品中Mg(ClO3)2·6H2O的质量分数为(2.741g÷3.50 g)×100%=78.3%
考点:考查常用作催熟剂、除草剂等氯酸镁[Mg(ClO3)2]的制取及成分测定的知识。

 阅读快车系列答案
阅读快车系列答案


 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
