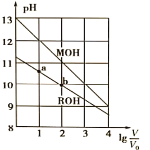
МвДҝДЪИЭ
ЎҫМвДҝЎҝІјВе·ТҫЯУРҪөОВәНТЦЦЖ·ОІҝСЧЦўөДЛ«ЦШЧчУГЎЈТ»ЦЦЦЖұёІјВе·ТөДәПіЙВ·ПЯИзПВЈә
ТСЦӘЈәўЩCH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
ўЪ![]()
![]()
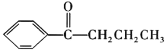 +HCl
+HCl
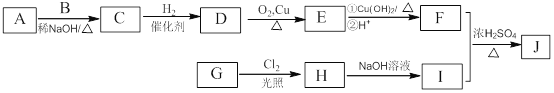
»ШҙрПВБРОКМвЈә
(1)A өД»ҜС§ГыіЖ_____Ј¬GЎъH өД·ҙУҰАаРН_____Ј¬H ЦР№ЩДЬНЕөДГыіЖ_________ЎЈ
(2)·ЦЧУЦРЛщУРМјФӯЧУҝЙДЬФЪН¬Т»ЖҪГжЙПөД E өДҪб№№јтКҪ_____ЎЈ
(3)IЎъK өД»ҜС§·ҪіМКҪОӘ_____ЎЈ
(4)Рҙіц·ыәППВБРМхјюөД D өДН¬·ЦТм№№МеөДҪб№№јтКҪ_____ (І»ҝјВЗБўМеТм№№)ЎЈ
ўЩДЬУл FeCl3ИЬТә·ўЙъПФЙ«·ҙУҰЈ»
ўЪ·ЦЧУЦРУРТ»ёцКЦРФМјФӯЧУЈ»
ўЫәЛҙЕ№ІХсЗвЖЧУРЖЯЧй·е
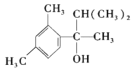
(5)РҙіцТФјд¶юјЧұҪЎўCH3COCl әН(CH3)2CHMgCl ОӘФӯБПЦЖұё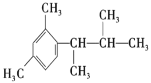 өДәПіЙВ·ПЯ________ (ОЮ»ъКФјБИОСЎ)
өДәПіЙВ·ПЯ________ (ОЮ»ъКФјБИОСЎ)
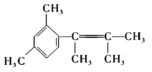
Ўҫҙр°ёЎҝјЧұҪ ПыИҘ·ҙУҰ МјМјЛ«јьЎўхҘ»щ ![]() »т
»т![]()
![]() +H2O
+H2O![]()
![]() +CH3OH
+CH3OH ![]()
![]()
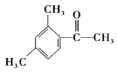
![]()
![]()
![]()
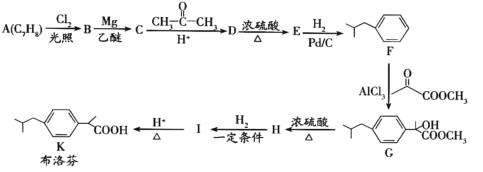
ЎҫҪвОцЎҝ
A(јЧұҪ)УлВИЖшФЪ№вХХМхјюПВ·ҙУҰЙъіЙB(![]() )Ј¬
)Ј¬![]() УлMgЎўТТГС·ўЙъАаЛЖРЕПўўЩөД·ҙУҰЙъіЙ
УлMgЎўТТГС·ўЙъАаЛЖРЕПўўЩөД·ҙУҰЙъіЙ![]() Ј¬
Ј¬![]() Ул
Ул![]() ФЪЛбРФМхјюПВ·ўЙъАаЛЖРЕПўўЩөД·ҙУҰЙъіЙD(
ФЪЛбРФМхјюПВ·ўЙъАаЛЖРЕПўўЩөД·ҙУҰЙъіЙD(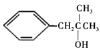 )Ј¬
)Ј¬ ФЪЕЁБтЛбјУИИМхјюПВ·ўЙъПыИҘ·ҙУҰЙъіЙE(ҝЙДЬөДҪб№№
ФЪЕЁБтЛбјУИИМхјюПВ·ўЙъПыИҘ·ҙУҰЙъіЙE(ҝЙДЬөДҪб№№![]() »т
»т![]() )Ј¬
)Ј¬![]() »т
»т![]() УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙFЈ¬FУл
УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙFЈ¬FУл![]() ·ўЙъјУіЙ·ҙУҰЙъіЙGЈ¬G·ўЙъПыИҘ·ҙУҰЙъіЙH(
·ўЙъјУіЙ·ҙУҰЙъіЙGЈ¬G·ўЙъПыИҘ·ҙУҰЙъіЙH(![]() )Ј¬
)Ј¬![]() УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙIЈ¬IФЪЛбРФМхјюПВЛ®ҪвЙъіЙKЎЈ
УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙIЈ¬IФЪЛбРФМхјюПВЛ®ҪвЙъіЙKЎЈ
(1)AөД»ҜС§ГыіЖјЧұҪЈ¬ёщҫЭGЎъHөД·ҙУҰМхјюәНKөДҪб№№өГіц·ҙУҰАаРНОӘПыИҘ·ҙУҰЈ¬H(![]() )ЦР№ЩДЬНЕөДГыіЖМјМјЛ«јьЎўхҘ»щЈ»№Кҙр°ёОӘЈәјЧұҪЈ»ПыИҘ·ҙУҰЈ»МјМјЛ«јьЎўхҘ»щЎЈ
)ЦР№ЩДЬНЕөДГыіЖМјМјЛ«јьЎўхҘ»щЈ»№Кҙр°ёОӘЈәјЧұҪЈ»ПыИҘ·ҙУҰЈ»МјМјЛ«јьЎўхҘ»щЎЈ
(2)EЦРә¬УРМјМјЛ«јьЈ¬·ЦЧУЦРЛщУРМјФӯЧУҝЙДЬФЪН¬Т»ЖҪГжЙПөДEөДҪб№№јтКҪ![]() »т
»т![]() Ј»№Кҙр°ёОӘЈә
Ј»№Кҙр°ёОӘЈә![]() »т
»т![]() ЎЈ
ЎЈ
(3)IЎъKКЗФЪЛбРФМхјюПВ·ўЙъЛ®Ҫв·ҙУҰЈ¬Жд»ҜС§·ҪіМКҪОӘ![]() +H2O
+H2O![]()
![]() +CH3OHЈ»№Кҙр°ёОӘЈә
+CH3OHЈ»№Кҙр°ёОӘЈә![]() +H2O
+H2O![]()
![]() +CH3OHЎЈ
+CH3OHЎЈ
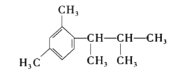
(4)·ыәППВБРМхјюўЩДЬУл FeCl3ИЬТә·ўЙъПФЙ«·ҙУҰЈ¬ЛөГчә¬УР·УфЗ»щЈ»ўЪ·ЦЧУЦРУРТ»ёцКЦРФМјФӯЧУЈ¬ЛөГчУРТ»ёцМјФӯЧУБ¬өДЛДёцФӯЧУ»тФӯЧУНЕІ»ПаН¬Ј»ўЫәЛҙЕ№ІХсЗвЖЧУРЖЯЧй·еЈ¬DөДН¬·ЦТм№№МеөДҪб№№јтКҪ![]() Ј»№Кҙр°ёОӘЈә
Ј»№Кҙр°ёОӘЈә![]() ЎЈ
ЎЈ
(5)ПИКЗёщҫЭРЕПўўЪ
![]()
 Ј¬
Ј¬ Ул(CH3)2CHMgClФЪЛбРФМхјюПВ·ҙУҰЙъіЙ
Ул(CH3)2CHMgClФЪЛбРФМхјюПВ·ҙУҰЙъіЙ Ј¬
Ј¬ ФЪЕЁБтЛбЧчУГПВ·ўЙъПыИҘ·ҙУҰЙъіЙ
ФЪЕЁБтЛбЧчУГПВ·ўЙъПыИҘ·ҙУҰЙъіЙ Ј¬
Ј¬ УлЗвЖшФЪҙЯ»ҜјБЧчУГПВ·ўЙъјУіЙ·ҙУҰЙъіЙ
УлЗвЖшФЪҙЯ»ҜјБЧчУГПВ·ўЙъјУіЙ·ҙУҰЙъіЙ Ј»ТтҙЛБчіМНјОӘЈә
Ј»ТтҙЛБчіМНјОӘЈә
![]()

![]()

![]()

![]()
 Ј»№Кҙр°ёОӘЈә
Ј»№Кҙр°ёОӘЈә
![]()

![]()

![]()

![]()
 ЎЈ
ЎЈ

ЎҫМвДҝЎҝФЪ2LөДГЬұХИЭЖчЦРЈ¬ҪшРРИзПВ»ҜС§·ҙУҰЈәCO2ЈЁgЈ©Ј«H2ЈЁgЈ©![]() COЈЁgЈ©Ј«H2OЈЁgЈ©Ј¬Жд»ҜС§ЖҪәвіЈКэKәНОВ¶ИtөД№ШПөИзПВұнЈә
COЈЁgЈ©Ј«H2OЈЁgЈ©Ј¬Жд»ҜС§ЖҪәвіЈКэKәНОВ¶ИtөД№ШПөИзПВұнЈә
tЎж | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэұнҙпКҪОӘK ЈҪ ЎЈ
ЈЁ2Ј©ёГ·ҙУҰОӘ ·ҙУҰЈЁСЎМоЎ°ОьИИЎұЎўЎ°·ЕИИЎұЈ©ЎЈ·ҙУҰҙпЖҪәвәуЈ¬ИфФЩНЁИлТ»¶ЁБҝCO2Ј¬ФтЖҪәвіЈКэKҪ«________Ј¬CO2өДЧӘ»ҜВК________ЎЈ(МоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)
ЈЁ3Ј©ДЬЕР¶ПёГ·ҙУҰКЗ·сҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДТАҫЭКЗ ЈЁ¶аСЎҝЫ·ЦЈ©ЎЈ
aЈ®ИЭЖчЦРС№ЗҝІ»ұд bЈ®»мәПЖшМеЦРc(CO)І»ұд cЈ®vХэ(H2)ЈҪvДж(H2O) dЈ®c(CO2)ЈҪc(CO)
ЈЁ4Ј©Иф 600ЎжКұЈ¬ПтИЭЖчЦРідИл1mol COЎў1mol H2OЈ¬·ҙУҰҙпөҪЖҪәвәуЈ¬COөДЧӘ»ҜВККЗ ЎЈ
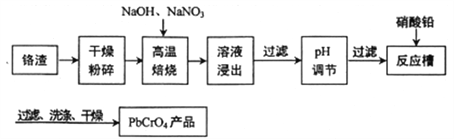
ЎҫМвДҝЎҝЦШёхЛбјШ(K2Cr2O7)ОӘУГНҫј«№гөДёх»ҜәПОпЈ¬№©ЦЖёх·ҜЎЈ»рІсЎўёхСХБПЎўІў№©ч·ёпЎўөз¶ЖЎўУР»ъәПіЙөИУГЎЈёхМъҝуөДЦчТӘіЙ·ЦҝЙұнКҫОӘFeOЎӨCr2O3Ј¬»№ә¬УРSiO2ЎўAl2O3өИФУЦКЈ¬ТФёхМъҝуОӘФӯБПЦЖұёK2Cr2O7ҫ§МеөД№эіМИзНјЛщКҫЈә

ёщҫЭМвТв»ШҙрПВБРОКМвЈә
ЈЁ1Ј©¶НЙХКұЈ¬ёхМъҝу·ўЙъёҙФУ·ҙУҰЙъіЙNa2CrO4әНNaFeO2Ј¬Н¬КұФУЦКSiO2ЎўAl2O3УлNa2CO3·ўЙъ·ҙУҰЈ¬ЖдЦРAl2O3·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪКЗ___ЎЈ
ЈЁ2Ј©NaFeO2УцЛ®ЗҝБТЛ®ҪвЙъіЙВЛФьlөД·ҙУҰАлЧУ·ҪіМКҪКЗ___ЎЈ
ЈЁ3Ј©ВЛТә1әНВЛТә2ҫщРиөчҪЪИЬТәpHЈ¬ВЛТә1өчҪЪpHОӘ7Јӯ8ДҝөДКЗ___Ј¬ВЛТә2өчҪЪpHФјОӘ5ДҝөДКЗ___ЎЈ
ОпЦК | ИЬҪв¶И/(g/100gЛ®) | ||
0Ўж | 40Ўж | 80Ўж | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
ЈЁ4Ј©ПтNa2Cr2O7ИЬТәЦРјУИлKCl№ММеЈ¬ОціцK2Cr2O7ҫ§МеЎЈҙЛ·ЁДЬ№»ЦЖөГK2Cr2O7ҫ§МеөДФӯТтКЗЈә___Ј»ОӘБЛҙУИЬТәЦРөГөҪҪП¶аK2Cr2O7ҫ§МеөДІЩЧч№эіМКЗЈә___Ўў№эВЛЎўПҙөУЎўёЙФпЎЈҪ«өГөҪөДK2Cr2O7ҫ§МеҪшТ»ІҪҙҝ»ҜІЩЧчКЗЈә___ЎЈ
ЈЁ5Ј©K2Cr2O7РФЦКЈәНщK2Cr2O7ИЬТәЦРјУИлAgNO3ИЬТәЈ¬ЙъіЙТ»ЦЦЧ©әмЙ«іБөнЎўИЬТәөДpHјхРЎЈ¬·ҙУҰАлЧУ·ҪіМКҪКЗ___ЎЈ
ЈЁ6Ј©K2Cr2O7ІъЖ·ә¬БҝІв¶ЁЈәЧјИ·іЖИЎКФСщ2.5gЕдіЙ250mLИЬТәЈ¬УГТЖТә№ЬОьИЎ25.00mLИЬТә·ЕИлөвБҝЖҝЈ¬јУИл10mL2mol/LБтЛбЎў2gKIУЪ°өҙҰ5minЈ¬БнјУ100mLЛ®Ј¬УГ0.2000mol/L Na2S2O3ұкЧјТәөО¶ЁЦБИЬТә»ЖВМЙ«Ј¬ФЩјУ3mLөн·ЫИЬТәјМРшөО¶ЁЦБА¶Й«НКИҘІўіКББВМЙ«ЎЈЖҪРРИэҙОКөСйЈ¬ЖҪҫщПыәДNa2S2O3ұкЧјТәөДМе»э25.00mLЎЈK2Cr2O7ІъЖ·өДҙҝ¶ИОӘ___ЎЈ
УР№Ш·ҙУҰИзПВЈәK2Cr2O7Ј«6KIЈ«7H2SO4=Cr2(SO4)3Ј«4K2SO4Ј«3I2Ј«7H2O
2Na2S2O3Ј«I2=Na2S4O6Ј«2NaI