题目内容
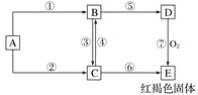
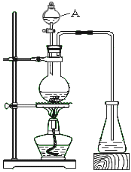
【题目】实验室用甲酸和浓硫酸反应制备CO,用于还原氧化铜,实验装置图和实验步骤如下:

①按上图连接好装置,检查装置气密性。
②点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③在完成某项操作后,点燃另外两处酒精灯。
④反应结束后熄灭酒精灯,待产物冷却至室温后,收集产物。
请回答下列问题:
Ⅰ.(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有_____________。
A.氧化性 B.脱水性 C.吸水性
(2)NaOH溶液的作用是_________。实验步骤③某项操作是指___________;
(3)若干燥管中的固体颗粒堵塞干燥管的出口,则装置Ⅱ中出现的现象为:_____________;
(4)该实验能证明HCOOH受热产物中有CO的现象为:___________________;
(5)实验步骤④中酒精灯I、III和Ⅳ的熄灭顺序为_______________。
Ⅱ.学习小组查阅资料知:
①Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。
②4CuO![]() 2Cu2O + O2↑ ③Cu2O +2H+=Cu +Cu2+ + H2O
2Cu2O + O2↑ ③Cu2O +2H+=Cu +Cu2+ + H2O
因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(6)请你评价该方案的合理性,并简述理由:
方案:_______________,理由:_______________________。
【答案】B 洗气,除去酸性气体 验纯(检验CO的纯度) 长颈漏斗中液面上升 装置IV中黑色固体变红;装置III中的澄清石灰水变浑浊 IV 、I 、III 合理 因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝
【解析】
Ⅰ.(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有脱水性,答案选B。
(2)由于浓硫酸还具有强氧化性,则生成的CO中可能还含有酸性气体,会干扰后续的实验,所以NaOH溶液的作用是洗气,除去酸性气体。由于CO是可燃性气体,因此实验步骤③某项操作是指验纯(检验CO的纯度);
(3)若干燥管中的固体颗粒堵塞干燥管的出口,则装置Ⅱ中压强增大,所以出现的现象为长颈漏斗中液面上升;
(4)CO能与氧化铜反应生成二氧化碳和铜,所以该实验能证明HCOOH受热产物中有CO的现象为装置IV中黑色固体变红;装置III中的澄清石灰水变浑浊;
(5)CO有毒完全点燃除去尾气,为防止空气中的氧气氧化生成的铜,所以实验步骤④中酒精灯I、III和Ⅳ的熄灭顺序为IV、I、III;
Ⅱ.(6)由于Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝,而铜与稀硫酸不反应,因此实验方案是合理的。

 阅读快车系列答案
阅读快车系列答案